Hibás feltevésen alapult, mégis világszám lett Mengyelejev periódusos rendszere

Mi a közös a reformációban, Semmelweis Ignácban, a családokban és a periódusos rendszerben? Hát az, hogy mindegyik kapott magának egy teljes emlékévet. Tavalyelőtt az ötszáz éves reformációt, tavaly, igaz, csak Magyarországon Semmelweis Ignácot és egy hirtelen ötlettől vezérelt döntés nyomán a családokat ünnepelhettük. A legnagyobbat azonban mégiscsak a periódusos rendszer futhatja idén. Dimitrij Mengyelejev orosz kémikus táblázatát 2019-ben az UNESCO döntése nyomán az egész világon ünneplik. Az egyéves fiesztát egész napos előadássorozattal és komolyzenei koncertekkel nyitották meg január 29-én.
„Be kell látni…”
A világ talán leghíresebb katalógusát, a kémia tanításának szentelt osztálytermek falát világszerte borító periódusos rendszert a szibériai Tobolszkban született Dmitrij Mengyelejev alig 35 évesen dolgozta ki 1869-ben, amikor kémiai viselkedésük alapján sorokba és oszlopokba rendezte az akkor ismert 63 elemet.

A végeredményt először néhány kollégájával osztotta meg. Lelkesedésük nem volt ugyan kirobbanó, márciusban a táblázatot mégis beletette A kémia alapelvei című kötetébe. A periódusos rendszer alapelveit ekként foglalta össze:
- Ha az elemeket az atomsúlyaik alapján rendszerezzük, nyilvánvaló periodicitást mutatnak.
- A kémiai jellemzőikben hasonló elemeknek megfeleltethető egymásnak az atomsúlyuk (például: platina, iridium, ozmium), vagy az atomsúlyuk periodikus jelleggel növekszik (például: kálium, rubídium, cézium).
- Az elemek atomsúly szerinti elrendezése megfeleltethető az úgynevezett vegyértéküknek, mint ahogy a többi kémiai jellegzetességüknek is.
- A legszélesebb körben előforduló elemeknek a legkisebb az atomsúlya.
- Az atomsúly nagysága meghatározza az elemek jellegzetességeit, éppúgy, ahogy egy molekula nagysága is meghatározza egy vegyület karakterét.
- Be kell látni, hogy további elemek felfedezése várható. Olyanoké, amelyek hasonlóak például az alumíniumhoz vagy a szilíciumhoz.
- Előfordulhat, hogy egy ismert elem atomsúlyát a szomszédos elemek atomsúlyai ismeretében módosítani kell.
- Az elemek bizonyos jellegzetességeire a súlyuk alapján lehet következtetni.
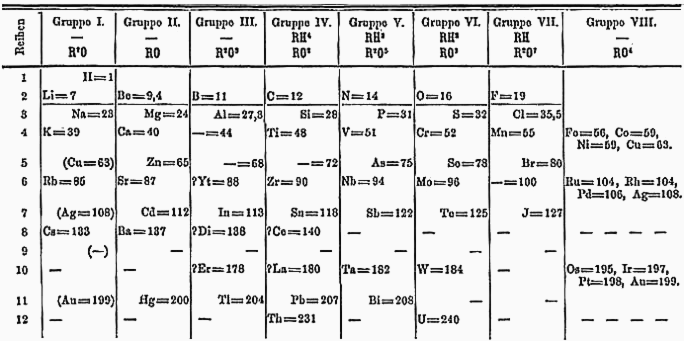
Futottak még, de nem értek célba
Korántsem Mengyelejev volt az első, aki megkísérelt a természetben megtalálható elemekből koherens rendszert alkotni. John Dalton angol kémikus már a 19. század elején próbálta azt bizonyítani, hogy az elemek vegyülési hajlandósága, vagyis kémiai viselkedése és azok egyedi jellegzetességei eltérő tömegükből következik. Dalton éppen ezért meg is próbálta az akkoriban ismert elemek egységnyi alkotórészét megmérni. A tömegüket egymáshoz viszonyítva, a különböző vegyületekben való előfordulásuk alapján próbálta megadni. Az elemeknek kis ikonokat is kitalált, ezek használata azonban végül nem terjedt el.

Mint az utóbb kiderült, a méricskélésben is követett el komoly hibákat. Például mert a tudomány akkori állása alapján nem tudhatta, hogy a vízmolekula nem egy-egy oxigénből és hidrogénből áll, hanem utóbbiból kettőt is tartalmaz. Atommérési kísérleteivel ugyanakkor Dalton örökre beírta magát a tudománytörténetbe, még ha az atomtömegek pontos méréséhez több mint száz évet kellett is várni a tömegspektrométer kifejlesztéséig. Más kérdés, hogy az atomtömegek ma is viszonyszámot jelölnek: az összes elem atomtömegét a szén 12-es izotópjának tömegéhez viszonyítják.
Dalton nyomdokain mindenesetre egy másik kémikus, a német Johann Wolfgang Döbereiner azt is elkezdte pedzegetni, hogy az elemek tulajdonságai között lehet némi összefüggés. Az általa ismert elemeket éppen ezért triádokba próbálta rendezgetni és – például a lítium—nátrium—kálium, valamint a kalcium—stroncium—bárium hármasára alapozva – azt állította, hogy a középső elem atomtömege megközelítőleg azonos a két mellette lévő elem tömegének a számtani közepével. Triádgyűjteményébe azonban az akkoriban ismert elemeknek csak egy részét tudta besuvasztani.
Tovább jutott viszont John Newlands angol és Lothar Meyer német kémikus. Mindketten állították, hogy az elemek legfőbb jellemzői és kémiai viselkedésük periodicitást mutat, vagyis az elemeket megfelelő sorrendbe rendezve a kémiai tulajdonságaik ismétlődnek. Meg is próbálták az összes általuk ismert elemet egyetlen rendszerbe foglalni, de nem jártak sikerrel, táblázataikba ugyanis túl sok hiba került.
Üres helyekkel pótolt hiányt
Mengyelejevnek anélkül sikerült, ráadásul a jelek szerint végérvényesen, kiigazítania az elődei ejtette csorbát, hogy a korábbiaktól eltérő, új elmélettel állt volna elő. Zsenialitása leginkább merészségében rejlett: legfőbb újítása az volt, hogy meg sem próbálta egymás mellé erőltetni azt, ami nem illett össze. 1869-ben úgy foglalta egyetlen táblázatba az akkoriban ismert 63 elemet, hogy a periódusos rendszerében számos, akkor még ismeretlen elemnek hagyott ki helyeket – világította meg Mengyelejev korszakalkotó munkájának a lényegét a Qubit kérdésére Lente Gábor, a Pécsi Tudományegyetem Általános és Fizikai Kémiai Intézetének professzora. Így például a bór alatti, akkor még ismeretlen elemet ekabórként, az alumínium alattit ekaalumíniumként, a szilícium alattit pedig ekaszilíciumként jelölte. Az ekképp megjósolt, és az 1870-es, illetve 1880-as években fel is fedezett szkandiumnak, galliumnak és germániumnak, a táblázatban általa kijelölt helyeik alapján jónéhány tulajdonságát is előre jelezte – mint utóbb kiderült, helyesen.

Legfényesebben a gallium és a germánium támasztotta alá, hogy Mengyelejevnek sikerült, ami a többieknek előtte nem. Még csak nem is azért, mert a szóban forgó fémek leírása egyébként meglepően pontos volt, hanem mert a periódusos rendszerben egymás mellett vannak. Rendkívüli magabiztosság kellett ahhoz, mondja Lente professzor, hogy mindössze 63 elem ismeretében két egymás melletti rubrikát bárki üresen merjen hagyni.
Paradox módon Mengyelejev rendszerét véste kőbe az is, hogy 30 évvel a megalkotása után egy egész oszlopnyi új elemet fedeztek fel. A nemesgázok legtöbbjét izoláló, teljesítményéért 1904-ben kémiai Nobel-díjjal elismert William Ramsay brit vegyésznek az argon 1894-es felfedezése után Mengyelejev táblázatából kiindulva sikerült izolálnia a héliumot, a neont, a kriptont a xenont és végül 1910-ben a radioaktív radont is. Ezzel a 118-as rendszámú oganesszon 1999-es előállításáig Ramsay jegyezte a kémiai elemek teljes VIII. főcsoportját. A vadonatúj főcsoport azzal támasztotta alá Mengyelejev igazát, hogy a táblázat megváltoztatása nélkül hozzá lehetett csapni az orosz kémikus által készített verzióhoz. Mengyelejev a nemesgázokat azért nem jósolhatta meg előre, magyarázza Lente, mert 1869-ben azok egyetlen tagját sem ismerhette. Kémiai viselkedésük alapján viszont, új oszlopként, tökéletesen illeszkedtek a táblázatba.

Mengyelejev kollégái felfedezései nyomán maga is élete végéig pontosítgatta periódusos rendszerét. 1904-ben közölt táblázatában a mangán alatt két elemet, a technéciumot és a réniumot is előre jelezte, csakúgy, mint a tellúr alatti polóniumot vagy a cézium alatti franciumot.
Merész volt, nem hibátlan
Mengyelejev rendszere korántsem aratott azonnal osztatlan sikert: táblázatát tudóstársai, nem kis mértékben épp az általa hagyott üres helyeknek köszönhetően, az orosz miszticizmus melléktermékének tekintették. Mengyelejevnek ráadásul a jósolgatás sem mindig jött be. Váltig állította például, hogy két olyan elemnek is lennie kell(ene), amely még a hidrogénnél is könnyebb. Mindkettőt nemesgáznak vélte, és ma már biztos, hogy egyik sem létezik.
Nem létező elemeket feltételezett a cérium, a molibdén vagy a kadmium alatt is. Ezeket a tévedéseket az magyarázza, hogy a ritkaföldfémek közé tartozó lantanoidákat, legalábbis a sornak, avagy a periódusnak már az ő korában is ismert tagjait Mengyelejev eredetileg mindenáron be akarta suvasztani a mára két részből álló táblázat fő, akkor egyetlen részébe.
A ritkaföldfémeket Glenn Seaborg amerikai magkémikus végül jóval később kiemelte, és a táblázat alá két külön sorba rendezte. (Az ugyanitt található transzurán elemek közül egyébként kilencet maga Seaborg fedezett fel, amivel nemcsak Nobel-díjat érdemelt ki, hanem egy elemnevet is: a 106-os seaborgiumét). Az átrendezést az indokolta, hogy a ritkaföldfémek, vagyis a lantanoidák és az aktinoidák jobban hasonlítanak egymásra, mint az eredeti sorrendben az alattuk és a felettük lévőkre.
Seaborg egyébként élete végéig szívén viselte a periódusos rendszer sorsát. Még halála évében, 1999-ben is jelent közleménye, amelyben azt taglalta, hogyan kellene majd a jövőben felfedezendő új elemekkel kinéznie a periódusos rendszernek. Úgy vélte, hogy a 168-as rendszámig várható még új elemek felfedezése. Ez azonban a mai módszerekkel felettébb valószínűtlen. A bravúrhoz, legalábbis Lente Gábor szerint, új tudományos ötletekre lenne szükség.
Mitől periódusos a rendszer?
Más kérdés, hogy az eredeti periódusos rendszer is egy olyan tudományos ötleten alapult, ami utóbb tévesnek bizonyult. Mengyelejev 8 alapvetése közül mindjárt az elsőről kiderült, hogy még akkor sem igaz, ha egyébként többnyire helyes eredményre vezet. Az elemek periodicitását, vagyis kémiai tulajdonságaik ismétlődését ugyanis nem az atomtömegük, hanem az elektronhéj-szerkezetük határozza meg.
Erről azonban Mengyelejev mit sem tudhatott, az elektronok és az atommagok viselkedését leíró kvantumfizika alapelveit ugyanis a (mag)fizikusok csak jóval az orosz kémikus 1907-es halála után, az 1920-as évek második felében fektették le. Sőt, magát az elektront is csak a periódusos rendszer megalkotása után három évtizeddel fedezték fel. Henry Moseley tragikusan fiatalon elhunyt brit fizikus pedig 1913-ban rendelte az elemek mellé azok rendszámait, vagyis azt a számot, ami a periodicitásért valójában felel. A rendszámból derül ki, hogy az elemek egy-egy atomjának a magjában mennyi proton, illetve az elektronhéjaikon mennyi elektron van.
Mengyelejev érdemeiből semmit nem von le, hogy nem tudta a valódi magyarázatát annak, miért működik a rendszere. Táblázata azért lett időtálló, véli Sükösd Csaba, a Budapesti Műszaki és Gazdaságtudományi Egyetem Nukleáris Technikai Intézetének címzetes egyetemi tanára, mert ebben a témában elsőként tudott végighaladni a tudományos megismerési folyamat összes alapvető lépésén. Elődeitől eltérően nemcsak rendszerezte az általa ismert elemeket, hanem egyúttal modellt is alkotott, amely alapján utóbb kísérletileg is ellenőrizhető jóslatokat tudott megfogalmazni. A modellről pedig, mondja Sükösd, miután a jóslatok közül több is valóságosnak bizonyult, egyértelműen kiderült, hogy az összes hibája ellenére is jól működött.
Másfélszáz év alatt nem csinált jobbat senki
A modell olyan jól sikerült, hogy az elmúlt 150 évben sokan próbáltak alternatív periódusos rendszereket piacra dobni, de ezek egyike sem terjedt el. Heinrich Baumhauer német kémikus például alig egy évvel Mengyelejev táblázatának megjelentetése után állt elő spirál alakú rendszerével. Az övét számos további spirális elrendezésű táblázat követte: Hugo Erdmann német vegyészé 1902-ben, az amerikai Charles Nodderé 1920-ban, illetve honfitársáé, bizonyos O. J. Stewarté 1928-ban.
Vállalkozó szellemű reformerek Magyarországon is akadtak: Lakatos Béla és Szabó Zoltán szegedi vegyészprofesszorok az 1950-es években próbáltak meghonosítani egy olyan táblázatot, amelyben az átmenetifémek néhány képviselője, például az arany, a cink, a higany, illetve az ezüst, inkább a bór- és a széncsoport elemeivel tartozik össze. Vagyis a magyar verzióban a cink- és a rézcsoporttól balra elhelyezkedő többi átmenetifémtől távolabb estek. A Lakatos—Szabó-féle periódusos rendszer híre a nemzetközi szakirodalomig el sem jutott, végül pedig Magyarországon is felhagytak a népszerűsítésével.
Más kérdés, hogy időközben a mengyelejevi rendszer is átesett jónéhány ráncfelvarráson. A periódusos rendszer ma is ismert, elnyújtott alakját, amelyben a periódusokat, vagyis a vízszintes sorokat itt-ott eltérő számú elem alkotja, az 1913-ban Nobel-díjjal elismert svéd Alfred Werner alkotta meg. Egy másik fontos változás pedig a ritkaföldfémek már említett elszeparálása volt.
Még ha a kémikusok számára Mengyelejevénél végül nem is akadt jobb rendszer, mégis voltak, akik eltérő szempontok alapján kívánták katalogizálni az elemeket. A magfizikusok például az 1940-es években azért, mert számukra a mengyelejevi rendszer rendező elve, vagyis az elemek elektronhéj-szerkezete semmilyen hasznos információval nem szolgál. Számukra kizárólag az atommagok felépítése érdekes, amelyekről azóta az is kiderült, teszi hozzá Sükösd professzor, hogy ugyancsak héjakba rendeződnek. Ennek felderítésében nagy szerepe volt az utóbb mindezért Nobel-díjjal elismert Wigner Jenő magyar fizikusnak is.
Az atommagok, avagy az izotópok táblázatában a Z jelöli a protonok, az n pedig a neutronok számát, a táblázat első töredék részében például így:
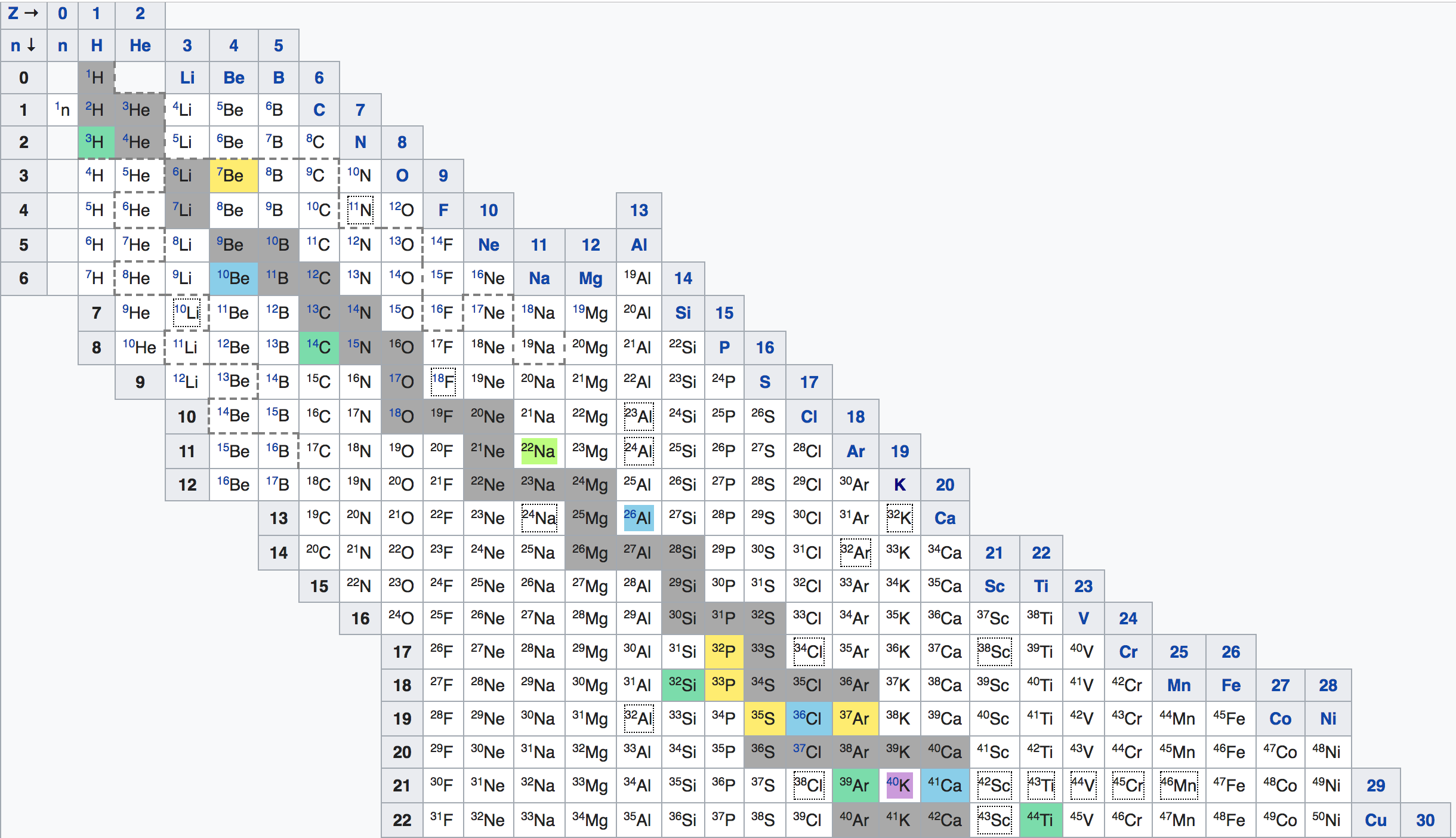
Az atommagok között azok számítanak különösen stabilnak, amelyekben a protonok vagy a neutronok zárt héjakon helyezkednek el. A magfizikusok elnyújtott lépcsőre emlékeztető izotóptáblázatában ezeket, vagyis az úgynevezett mágikus számokat fekete vonalak jelzik. A legstabilabbakban, például az oxigén 16-os, illetve az ólom 208-as izotópjában a protonok és a neutronok is zárt héjakat alkotnak.

Az ezredforduló után Bruce Railsback amerikai geológus is megirigyelhette a szakmára szabott elemrendszert. Olyan táblázatot alkotott, amelyben az elemeket az előfordulási helyük és töltésük szerint tünteti fel. Akár többször is. Miközben az izotóptáblázatnak az utóbbi 80 év során sikerült a mengyelejevi rendszerhez hasonlóan nélkülözhetetlenné válnia, a geológusok kissé kaotikus periódusos rendszere egyelőre nem állta ki az idők próbáját.
