Dobj fel egy marék gyöngyöt, és nézd meg, hogyan írhatják át életfolyamatok az entrópianövekedés törvényét!

A termodinamika szerint minden zárt rendszerben az entrópia, azaz a rendezetlenség foka növekszik valamennyi energiaátalakulási folyamatban. Az élet kialakulása azonban ennek épp az ellentéte, hiszen az élő szervezet magasan rendezett struktúra, amit szokás ezért az entrópia fordítottjával, a negentrópiával jellemezni. Ellentmondásról van-e szó, vagy ellenkezőleg, szükségszerű kapcsolatról? Járjunk utána!
Entrópia és rendezettség
Dobjunk fel egy marék gyöngyöt: a padlóra vagy a kövezetre esve nagy területen fognak szétszóródni. A szétszóródás oka a véletlen: rendkívül kicsi a valószínűsége, hogy véletlenül egymás közelében maradjanak a gyöngyök. Olyan eloszlásra számíthatunk, amely sokféleképp jöhet létre.
Hasonló probléma vetődik fel, amikor különböző fizikai közegek (gázok, folyadékok, szilárd anyagok) atomjainak, molekuláinak eloszlását, mozgásait akarjuk jellemezni. Abból indulunk ki, hogy az egyes lehetséges eloszlások és mozgásformák összesen hányféle módon valósulhatnak meg, ezt hívjuk a mikroállapotok számának (Ω), amelynek logaritmusát képezve jutunk el egy fizikai fogalomhoz, az entrópiához:
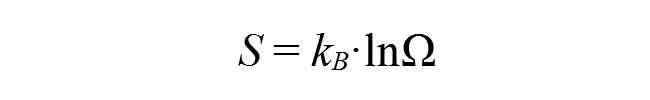
ahol kB = 1,38·10-23 J/K a Boltzmann-állandó.
Visszatérve a gyöngyök példájára, a feldobást követő szétszóródást is jellemezhetjük az entrópia növekedésével: sokkal valószínűbb, hogy a gyöngyök szétgurulnak, mint hogy együtt maradjanak. Ha viszont a gyöngyöket egy vékony, lezárt végű tölcsérbe szórjuk, akkor egymás közelében maradnak. Ekkor a gyöngyök entrópiája nem növekszik meg, viszont elfoglalják azt a pozíciót, ahol a potenciális energiának minimuma van.
Most válasszunk egy rugalmas gumiszőnyeget, amelyen kisebb-nagyobb huplik vannak: az együtt leejtett gyöngyök ekkor különböző irányokban ugrálni fognak, és végül szétterülnek egy nagyobb területen, több lesz a mélyebb, kevesebb a magasabb helyeken.
Ezek a példák szemléltetik a két alapvető rendező elvet: az egyik a potenciális energia – jelen esetben a gravitációs potenciál –, amely rendezi a gyöngyöket, és a másik az entrópia, amely a rendezetlen szétszóródás irányába hat. A kettő viszonya határozza meg, hogy a szétpattanó gyöngyök végül hogyan oszlanak el.
Mi a szabad energia?
A termodinamika tudománya segít, hogy a két elv hatását összevessük. Az energia és az entrópia ötvözete az A szabad energia, amely leírja, hogy valamilyen U potenciális energiával rendelkező rendszer (például valamilyen gáz) átalakulási folyamatai hogyan mennek végbe:
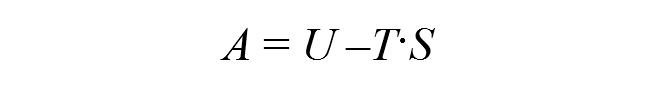
A folyamatok irányát a szabad energia minimuma határozza meg. A negatív előjel fejezi ki, hogy az S entrópia csökkenti a szabad energiát, azaz növekvő entrópia kisebb szabad energiát eredményez. A csökkenés mértékét a T abszolút hőmérséklet határozza meg, ahol a hőmérsékletet Kelvin egységben adjuk meg, amely a Celsius-foknál 273 fokkal nagyobb.
Az entrópia termodinamikai definícióját az anyagok Q hőmennyisége (termikus energiája) segítségével adhatjuk meg. Legyen szó akár gázról, folyadékról vagy szilárd anyagról, annak atomjai, molekulái rendezetlen mozgásokat végeznek, amelyekhez kinetikus energia tartozik. Ennek összege képezi a termikus energiát, azaz a hőmennyiséget. Ennek mértéke két dologtól függ: hányféle mozgásformával rendelkeznek a molekulák – ennek számát nevezzük szabadsági foknak –, és mekkora energiával rendelkeznek az egyes mozgásformák – ez utóbbi átlagértéke közvetlen összefüggésben van az abszolút hőmérséklettel.

Gázok esetén a molekulák véletlenszerű helyváltoztató (transzlációs) mozgásokat, valamint forgásokat végeznek, amit még kiegészítenek az atomok közötti kémiai kötések oszcillációi (vegyértékrezgések), továbbá a kötési szögek deformációs rezgései. Folyadékban ezek közül hiányoznak a transzlációs mozgások, ami az egy molekulára jutó szabadsági fokok számát hárommal csökkenti, míg szilárd fázisban a rotációs szabadsági fokok is elvesznek.
A termodinamika fontos törvénye, hogy termikus egyensúlyban minden egyes mozgásformára átlagban ugyanakkora energia jut. A termikus energia összetettebb mennyiség, mint a hőmérséklet, mert függ a molekulamozgások szabadsági fokától is. A termikus energia és a hőmérséklet aránya definiálja az entrópiát:
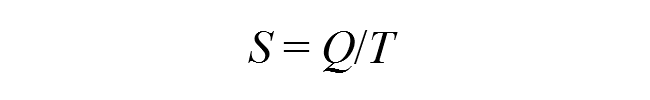
Az entrópia termodinamikai definíciója összhangban van az előzőekben említett valószínűségi értelmezéssel, mert a szabadsági fokok száma adja meg, hogy mekkora a lehetséges mikroállapotok száma. Ez a szám kulcsszerepet játszik, amikor a vizsgált rendszer molekuláinak összesített tulajdonságait határozzuk meg. Fázisváltozáskor, például amikor a víz gőzzé alakul, vagy a jég megolvad, újabb szabadsági fokok szabadulnak fel, ami a termikus energiát és ezáltal az entrópiát gyarapítja. Emiatt minden fázisátmenet az entrópia növekedésével jár együtt.
A termodinamika második főtörvénye mondja ki, hogy a potenciális és mozgási energia ide-oda alakulása során a teljes körfolyamat mindig az entrópia növekedésével jár együtt. Van azonban egy fontos kikötés: a törvény akkor érvényes, ha a rendszer zárt, azaz izolált a környezetétől. A második főtételt szokás úgy is megfogalmazni, hogy perpetuum mobile nem hozható létre, vagyis a szerkezetek mozgása előbb-utóbb leáll, ha nem pótoljuk vissza a mozgás során hővé alakuló mozgási energiát. Tehát alapvető természeti törvény, hogy minden rendezett mozgás idővel átmegy rendezetlen formába.
Keveredés és entrópia
A hőenergia és az entrópia kapcsolatát szemléltessük folyadékok vagy gázok spontán keveredésével. Válasszunk szét egy edényt két részre, és a két tartályba öntsünk kétféle folyadékot (hasonló kísérletet végezhetünk gázokkal is). Most távolítsuk el az elválasztó falat – mi történik? A két folyadék molekulái elkezdenek keveredni, és a végállapotban már egyenletesen oszlanak el a teljes tartályban. Tehát anélkül, hogy változna a hőmérséklet, vagy kívülről energiát vinnénk be, elindul egy folyamat, amelyet az entrópia növekedése vált ki. Ennek során a részlegesen rendezett, azaz nem keveredett állapot átmegy a rendezetlen keverék állapotba.
Keverék állapotban a molekulák a teljes edényben oszlanak szét, és nem csak annak felében, emiatt a rendelkezésre álló nagyobb térfogat megnöveli a mikroállapotok számát.
De ha az entrópia megnőtt, akkor a vele arányos hőenergia is nagyobb lesz! Ez azt jelentené, hogy munkabefektetés nélkül is megnövelhetjük a hőenergia mennyiségét?
A válasz megköveteli néhány fogalom további tisztázását. Szemben a jól mérhető hőmérséklettel az entrópia közvetlenül nem mérhető fizikai mennyiség. Alkalmazása hasznos a termodinamika törvényeinek megfogalmazásában, de valójában nem több, mint egy hasznos matematikai konstrukció.
A termodinamika második főtételéből következik, hogy a hőerőgépek a hőmérséklet változása által működnek, és hatásfokuk az alkalmazott hőmérsékletek különbségétől függ. Nézzük azt az esetet, amikor ennek hatására áramlás indul meg, erre példa a szélerőmű is. Az általános gáztörvény összefüggést állapít meg a nyomás, a gázt magában foglaló tartály térfogata és a hőmérséklet között:
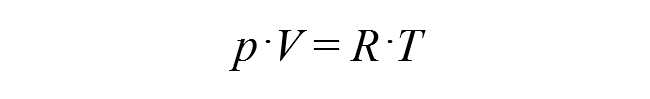
ahol p a nyomást, V a térfogatot jelöli, R általános gázállandó pedig a kB Boltzmann-konstans és az N = 6·1023 Avogadro-szám szorzata. Ha például a szárazföld és a tengerek között hőmérséklet-különbség alakul ki, akkor a magasabb hőmérsékletű helyen nagyobb lesz a nyomás, ami a levegőt a kisebb nyomású körzetek felé irányítja.
De mi a helyzet folyadékok keveredése esetén? Cseréljük ki a két részt elválasztó falat egy félig áteresztő és elmozdítható falra! Ez megengedi az egyik folyadék átlépését az elválasztó falon, de megakadályozza, hogy a másik áthatoljon rajta. Ekkor csak a második folyadék fog nyomást gyakorolni a falra. Azok a molekulák, amelyek átléphetnek a falon, megindulnak a másik térfél felé, a fal pedig ellenkező irányba fog elmozdulni.
A fal mozgási sebességét az impulzusmegmaradás törvénye szabályozza: a diffúzió átlagsebessége szorozva a diffundáló molekulák és a fal tömegének arányával. Ez a mozgás addig tart, amíg nem jön létre kiegyenlítődés, amikor a két folyadék koncentrációaránya mindenütt azonos, az entrópia pedig maximális lesz. Amíg tart az áramlás, beszélhetünk rendezett mozgásról, de megszűnésekor már csak rendezetlen irányú mozgások maradnak fenn.
A hőenergia megnövekedése tehát a rendezett diffúziós mozgás rendezetlen mozgásokká való átalakulásából származik, és evvel munkát tudunk végezni, amikor a fal elmozdul. Az egyszeri munkavégzés még nem gép, ehhez kell egy körfolyamat, ami jelen esetben a két folyadék szétválasztásával oldható meg. Emiatt érvényes marad a termodinamika követelménye, hogy a gép működéséhez hőmérséklet-különbségre van szükség, mert a szétválasztáshoz fel kell melegíteni a folyadékot, hogy az alacsonyabb forráspontú komponens elpárologjon.
A molekuláris bomlás és felépülés hatása az entrópiaváltozásra
Mi történik akkor, ha egy molekulát felbontunk több részre? Itt most nem avval foglalkozunk, hogy ez energia nyereséggel vagy befektetéssel jár, csak az entrópia változását akarjuk követni. Nézzük például a CO2 molekulát, amelyet felbontunk egy O2 oxigénre és egy szénatomra. Felbontás előtt az oxigén-szén távolság rögzített, viszont felbontás után már tetszőleges lehet.
Ez a szabadsági fok megnövekedését, azaz az entrópia növekedését idézi elő. Ha megfordítjuk a folyamatot, és elégetjük a szenet,a különálló szén és oxigén távolságát rögzítjük, amely szabadságfok- és entrópiacsökkenésnek felel meg. Evvel szemben áll az entrópianövekedés, amely az egymáshoz kötött szénatomok szétválasztásával jár együtt.
Légzés és entrópia, anyagcsere és entrópia – élet és entrópia
Minden élő szervezet, akár növényekről, akár állatokról van szó, önmagában egy magas szinten rendezett struktúra, ezért létrejöttük és növekedésük entrópiacsökkentő folyamat. Viszont az élet megszűnése után a bomlási folyamatok többé-kevésbé visszaadják ezt az entrópiát a környezetnek. Emiatt összességében az entrópiamérleget az életfenntartó folyamatok határozzák meg.
Növényeknél az asszimiláció és a gyökerek tápanyagfelvétele, állatoknál a légzés és a táplálkozás a legfontosabb folyamat az entrópiamérleg szempontjából. Hogyan befolyásolják ezek a globális entrópiamérleget?
Az ősi Föld atmoszférája döntően szén-dioxid gázból épült fel, amely az üvegházhatás miatt a jelenleginél jóval magasabb hőmérsékletet hozott létre. Az egysejtű baktériumok fejlődése során kialakult a szén-dioxidot felbontó asszimilációs mechanizmus. Ennek alapja, hogy felbontáskor a szén-dioxid-atmoszféra entrópiája annyira megnövekszik, hogy lehetőséget ad helyi rendezettségnövelő, entrópiacsökkentő mechanizmusok létrejöttére is.
Az élet létrejötte azonban nemcsak összhangban van a termodinamika második főtörvényével, hanem annak gyorsított érvényesülését is elősegíti. Az élő szervezetek növekedési és pusztulási szakaszai együttesen kiegyenlítik az entrópiamérleget, viszont a kettő közötti életfenntartó folyamatok már egyértelműen megnövelik az entrópiát. Ez magasabb szintre emelkedik a szárazföldi élet kialakulásával, mert a gyökerek felbontják és átalakítják az eredetileg homogén összetételű kőzeteket, létrehozva a kevert komponensekből álló talajt. A Földtörténet során a növényi asszimilációs folyamatok fokozatosan csökkentették a légkör szén-dioxid-koncentrációját és megnövelték az oxigénét.
A szén-dioxid-koncentráció csökkenése viszont lehűlést okozott, ami visszafogta a növényvilág fejlődését. Az állatvilág megjelenése fordulatot hozott a további lehűlés megakadályozásával, visszapótolva a szén-dioxidot a lélegzésen keresztül. A lélegzés ugyan önmagában entrópiacsökkentő folyamat a szén és oxigén egyesítése miatt, de ugyanakkor az „elégetett” szén magas rendezettségű szerves vegyületekből származik, ami már entrópianövekedéssel jár. Az anyagcsere egyértelműen entrópianövelést okoz, hiszen a magasan rendezett növényi és állati struktúrák elfogyasztásán alapul – ami szétbontási folyamat. Ez ugyan a szervezetbe beépülve csökkenti a szervezet entrópiáját, de a születés, növekedés és elmúlás entrópiakiegyenlítő hatása miatt a teljes életciklus már nagymértékű entrópianövekedést hoz magával.
Összességében tehát úgy foghatjuk fel az élet kialakulását, mint egy olyan folyamatot, amely felgyorsítja a földi entrópia növekedését. Az emberi tevékenység – különösen az ipari forradalom óta – tovább gyorsítja az entrópianövekedést, mert az ipar homogén összetételű, azaz rendezett szerkezetű, nyersanyagokat és energiaforrásokat használ fel. Igaz ugyan, hogy ebből magas rendezettségű, tehát csökkenő entrópiájú termékeket állítunk elő, de ezt jóval meghaladja a többletentrópia, amely a nyersanyagok és üzemanyagok felhasználásával, a hulladékok és salakanyagok termelésével jár együtt.
A Nap-Föld rendszer entrópiamérlege
A Föld nem zárt rendszer, hiszen az éltető energia a Napból érkezik. A Nap maga a fúziós folyamatok miatt nemcsak energiát, hanem entrópiát is termel. Bár a héliummagok felépítése a protonokból entrópiacsökkenést jelent, de a fúziós láncreakció lépéseiben neutrínók és fotonok kibocsátására kerül sor. Ezért a részecskék összes száma a fúzió során megnövekszik, és így nemhogy csökkenne, hanem növekszik az entrópia. Különösen a szabad energia növekszik nagymértékben a fúzió rendkívül magas hőmérséklete miatt.
A Föld és Nap együttes rendszerét már jó közelítésben vehetjük zárt rendszernek, ha elhanyagoljuk a kozmikus sugárzást és az aszteroidabecsapódásokat. Ebben a rendszerben a Nap nemcsak a sugárzott energiával, hanem entrópiájával is segíti bolygónkon az élet kialakulását. Az entrópia akkor tud gyorsan növekedni, ha a térben egyenlőtlen a rendezett és rendezetlen struktúrák eloszlása, mert ez mozgásokat, áramlásokat idéz elő, ami súrlódások, ütközések révén termeli a hőenergiát. Az élettel együtt járó magas rendezettséget is úgy tekinthetjük termodinamikai szemponttól, mint hajtóerőt az entrópia gyorsabb növekedése irányában.
A szerző fizikus, a BME és az ELTE címzetes egyetemi tanára.
A Qubiten a Kalandozások a fizikában címen futó sorozatának korábbi írásai itt olvashatók, tudósportréit pedig itt találod.
További kapcsolódó cikkek a Qubiten:
Létezik tökéletes szimmetria?
A tökéletes szimmetria nagyfokú rendezettséget jelent, ezt viszont megbolygatja a véletlen, ami többé-kevésbé megzavarja a szabályos sorok rendjét. Ennek mértékét adja meg a fizika az entrópiával. De hogyan sérül a tükrözési szimmetria a gyenge kölcsönhatásban?

Adhat-e magyarázatot a fizika a tudat megjelenésére?
Az entrópia fogalmával szinte minden magyarázható, az emberi társadalom fejlődése is felfogható az egyre nagyobb mérvű entrópiatermelés korszakaiként. De hol vannak a fizika határai? Rockenbauer professzor elmondja.
Miért hűl ki az asztalon hagyott étel, és mi tartja össze a bolygókat?
Rockenbauer professzor végre rendesen elmagyarázza, mi az az entrópia, miért nem építhető perpetuum mobile, és közben még egy varázslatot is bemutat. Csak a kezét figyeljék!