Soha nem készült még ilyen részletes kép a koronavírusban működő kíméletlen kis szerkezetről
A vírusok szaporodása összetett kérdés, és a kirakósból még számos darabka hiányzik. A nyitott kérdések megválaszolása pedig, ha lehet, még sürgetőbbé vált a koronavírus-világjárvány árnyékában. Minél jobban megismerik ugyanis a kutatók azoknak a folyamatoknak a részleteit, amelyek hatására egy vírusból több ezer lesz, annál valószínűbb, hogy képesek hatékony új gyógyszereket kidolgozni a világjárványt okozó SARS-CoV-2 ellen.
A Cellben közült új tanulmányukban a New York-i Rockefeller Egyetem molekuláris biofizikai laboratóriumában dolgozó kutatók a puzzle egy fontos, eddig hiányzó darabját illesztették a helyére: atomi szintű felbontásban adtak képet az új koronavírus szaporító rendszeréről. Egyikük, Elizabeth Campbell a Phys.org-nak azt mondta, „a most létrehozott járulékos strukturális sablon igen hasznosnak bizonyulhat, amikor kutatók a gyógyszerfejlesztés során olyan új összetevőket keresnek, amelyek bejuthatnak ebbe a molekuláris gépezetbe, és leállíthatják azt.”
Sok más vírushoz hasonlóan a genetikai anyag másolását a vírusok az RNS-függő RNS-polimeráz (RdRp) enzim segítségével oldják meg, amelynek a működése a nevének megfelelően összetett. Éppen azért, mert léte elengedhetetlen a vírusok szaporodásához, ez a gépezet az antivirális kutatások népszerű célpontja. Sőt néhány már létező antivirális szer – így a SARS-CoV-2 ellen sok helyen ma is bevetett, de bizonytalan hatékonyságú remdesivir – is az RdRp-t veszi célba.
Ezek az antivirális szerek a hatalmas RdRp molekula hasadékaiban és szögleteiben igyekeznek megkapaszkodni, és ezzel mintegy megakasztva a fogaskerekeket, leállítani a gép működését. Ehhez a kritikus összetevőnek egészen precízen kell felépülnie, amihez pedig az RdRp lehető legpontosabb képét kell elkészíteni. Ez az, ami most sikerült a Rockefeller kutatócsoportjának: egy eddig példátlan felbontású 3D térképet alkottak.
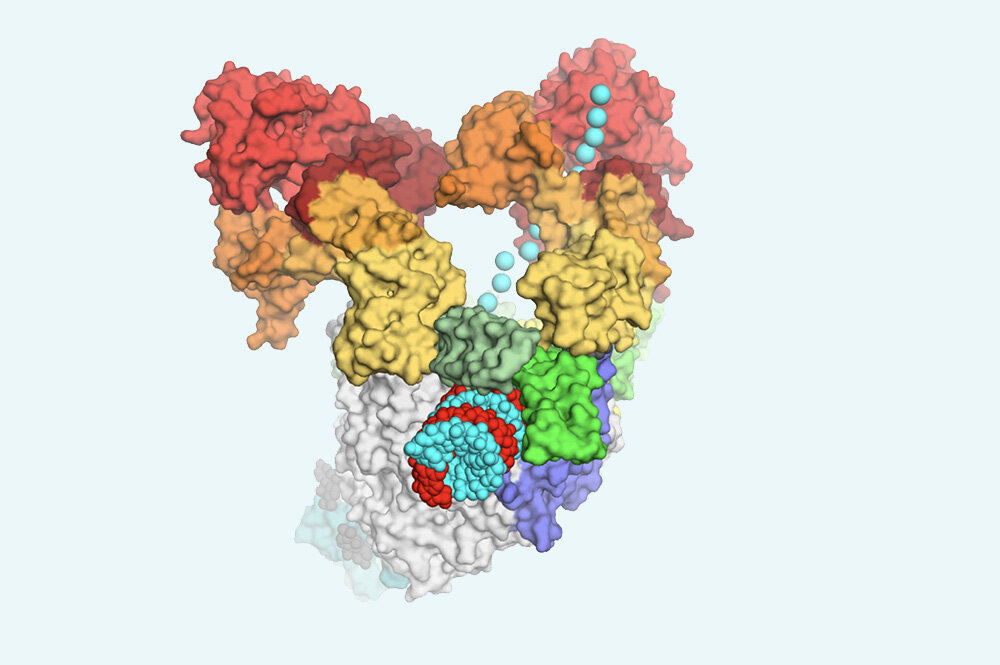
Sajnos az RdRp nem egyedül dolgozik, egy sor további fehérjével karöltve szaporítja a vírust, köztük a helikáz nevű enzimmel, amely önmagában szintén fontos célpont a koronavírus ellen hatásos szerek keresésében. Az RdRp és a hozzá tartozó fehérjék laboratóriumon kívül, eredeti környezetükben, egy fertőzött sejt belsejében valószínűleg ebben az egységben jelennek meg – mondta James Chen, a jelen tanulmány egyik szerzője.
A krio-elektronmikroszkópia (ez annyira friss technológia, hogy 2017-ben adtak érte kémiai Nobel-díjat) használatával a kutatók pontosan be tudták mutatni ezt az összetett szaporító gépezetet. Jó hír, hogy még ha össze is gabalyodik a vírusban az RdRp és a helikáz, a felszínükön a hasadékok ugyanúgy megmaradnak, és nem változtatják a formájukat, tehát azok a molekulák, amelyeket ezeknek a gátlására terveztek, valószínűleg akkor is működnek, ha nem laboratóriumi tiszta formájukban találkoznak az enzimekkel. Az új, szuperrészletes kép néhány további, gyógyszerek által potenciálisan támadható pontot is azonosított az enzimeken. Az egyik éppen a két molekula csatlakozásánál kínálkozik, és esélyes, hogy általa egy harmadik molekula megbonthatná az RdRp és a helikáz kötelékét.
A Cell folyóiratban július végén közölt eredmények többféleképpen is hozzájárulhatnak az emberi egészség megőrzéséhez: legközvetlenebbül azzal, hogy jelentősen felgyorsítják a COVID-19 ellenszerének kutatását.
Az RdRp-helikáz komplex térképének felbontása lehetővé teszi, hogy azokat a számítógépes kutatásokat is felgyorsítsák, amelyek virtuálisan tesztelik a gyógyszerjelöltek antivirális funkcióit a molekulák kémiai felépítéséről szerzett információik alapján. Brandon Malone, a tanulmányt készítő kutatók egyike úgy fogalmazott: „ha valaki olyan molekulákra vadászik, amelyek egy bizonyos kapcsolódási ponton kötődhetnek, sokat javít a számítások pontosságán, ha pontosan tudja, hogyan épül fel az a kötődési pont”.
A rockefelleresek munkája emellett segíthet pontosítani az arról szóló tudományos elméleteket, hogy a két enzim pontosan hogyan olvassa és másolja a genetikai információkat az összes úgynevezett RNS vírusban (amelyek közé számos kórokozó tartozik a koronavírustól az ebolán át az inlfuenzáig). Ahogy Chen fogalmazott, most már nemcsak modellezni tudják a vírusok szaporodásának mechanikáját, hanem tesztelni is képesek lesznek ezeket a modelleket.
Kapcsolódó cikkek a Qubiten:

Magyar kutatók: a mai élet alapja egy komplex kémiai önreprodukáló automata
A Nature Review Chemistry vaskos tanulmányban ismerteti a Szathmáry Eörs nevével fémjelzett magyar elméleti biológiai iskola eredményeit, amelyek feltárják a földi élet kialakulásának biokémiai folyamatait.
A Moderna vakcinája ígéretesen teljesített az első tesztelési fázisban
Az RNS típusú kísérleti oltóanyagok közé tartozó vakcina az enyhe mellékhatások mellett meggyőző immunválaszokat váltott ki a márciusban beoltott 45 önkéntes szervezetében.
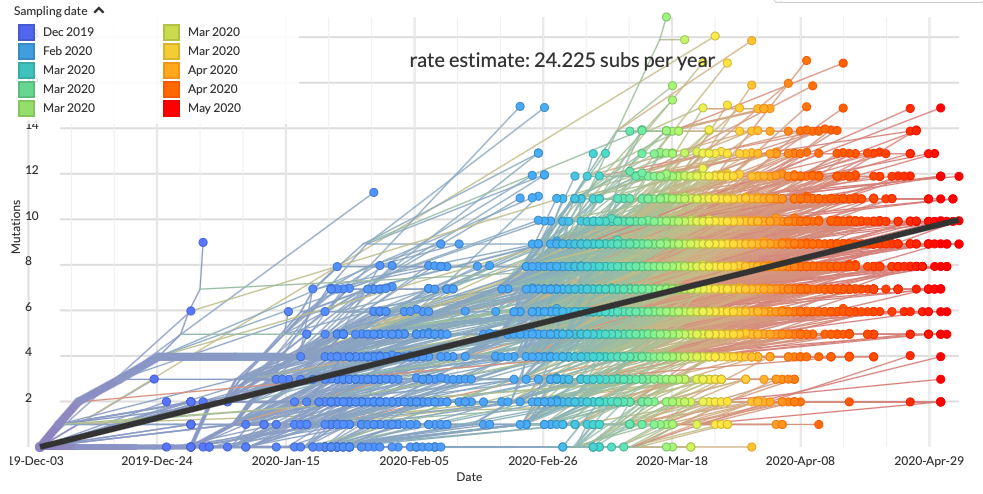
Hány SARS-CoV-2-vírustörzsről tudunk?
Spoiler: egyről. De ez nem jelenti sem azt, hogy a vírus nem változik, sem azt, hogy egyszer majd nem alakulhat ki egy új törzs.