Hasznos sejthalál a fejlődő agyban – magyar kutatók azonosították a kóbor sejtek gyilkosát

Agyunk fejlődése során milliónyi sejt milliárdnyi osztódáson megy keresztül. A nagy számok törvénye alapján ezekből lesz néhány olyan, ami nem úgy megy végbe, ahogy kellene, és ilyenkor a hibásan osztódó sejtektől meg kell szabaduljon a fejlődő szervezet. Ennek a különleges sejthaláltípusnak, az anoikisnak a fejlődéstani szerepét írta le nemrég a Katona István neurobiológus vezette kutatócsoport a Kísérleti Orvostudományi Kutatóintézetben.
De miért is fontos, hogy a fejlődő agy azon sejtjei, amelyek egyszer csak elveszítik a kapcsolatukat a környezetükkel, elpusztuljanak? Hogyan kapcsolódik ehhez az alkohol, és miért foglalkozik egy kannabiszkutató ilyesmivel? Katona Istvánnal készült beszélgetésünkből (ami egy fél évtizeddel ezelőtti impakták kvázi folytatása) fény derül ezekre a kérdésekre, mint ahogy arra is, hogy milyen hosszú és kacskaringós egy új tudományos felfedezés útja.
A beszélgetés minimálisan stilizált átiratát alább olvashatjátok.
Közel öt és fél évvel előző beszélgetésünk után, ami az egyik leghallgatottabb impakták-epizód lett („Hogyan hat a fű az agyra?”), ismét Katona Istvánnal beszélgetünk. A kutatás nem állt meg itt, de még mielőtt felvennénk a fonalat, arról kérdeznélek, hogy miként illeszkedett bele az a munka a korábbi kutatásaidba, amiről azt mondják szakértők, hogy mérföldkő a kannabiszkutatás történetében.
A tudományos megismerés ívét szépen illusztrálja, hogy az igazán izgalmas és fontos eredmények mindig a legmeglepőbb megfigyelésekből születnek, amiket nem tudunk előre megjósolni. Amikor tudományos pályázatot írok, mindig eszembe jut Esterházy Péter Harmonia Caelestisének a nyitómondata, miszerint „kutya nehéz úgy hazudni, ha az ember nem ismeri az igazságot”. A tudományos pályázatban meg kell jósoljuk, hogyan fog működni a természet, mert ha már tudnánk, miként működik, akkor nem is kellene arra pénzt kérni. Szerencsére vannak olyan pályázatok, ahol megengedik egy kicsit kockázatosabb projektek elvállalását. A mostani felfedezésünk is egy ilyen EU-s ERC-pályázatból indult.
Ahhoz, hogy ezt a pályázatot annak idején megkapjuk, szükség volt a bizalomra a saját kutatóközösségemtől, hogy ha adnak valami támogatást, akkor valami értéket fogunk tudni teremteni. Ehhez a bizalomhoz pedig szükség volt az előző évtized munkásságára, amit még Freund Tamással kezdtünk el. Akkoriban Tamás a világ egyik vezető kutatója volt az idegrendszerben, elsősorban az agykéregben és a hippokampuszban található sokféle gátló sejt területén. Olyan gátló sejttel kezdtünk el foglalkozni, amiről igazából semmit nem lehetett tudni, és minket az érdekelt, hogy miért van bennünk az a gátló sejt. Egy véletlen konferenciatalálkozás nyomán Tamás kapott egy kísérleti anyagot, amivel ezt a gátló sejtet a mikroszkópban láthatóvá tudtuk varázsolni. Ez az anyag egy antitest volt, amit ha hozzáadunk az agymetszetekhez, megtalálja a kannabinoid receptorfehérjét – ez az a receptorfehérje, amit a marihuána hatóanyaga, a THC molekula aktivál. Tehát igazából minket a gátló sejtek működése érdekelt még az 1990-es évek végén, de miközben elkezdtünk dolgozni ezen a témán, kiderült a számunkra is, hogy még abszolút nem érti az orvostudomány, hogy mi a kannabisznak a hatásmechanizmusa, mi a neurobiológiai magyarázat erre a rengetegféle terápiás hatásra, illetve a rendszeres használattal és nagy dózissal együtt járó mellékhatásokra.
Ekkor váratlan, nagyon szerencsés felfedezésre bukkantunk: azt találtuk, hogy a kémiai szinapszisokban, ahol az idegsejtek „beszélgetnek” egymással, ezeknek a gátló sejteknek az idegvégződésében nagyon nagy mennyiségben találhatók ezek a kannabinoidreceptorok. Nyilván ez után azon az izgalmas kérdésen kezdtünk el dolgozni, hogy miért van bennünk ez a receptor. Vannak olyan molekulák a mi szervezetünkben is, amelyek aktiválni tudják ezeket a repcetorokat. Ezeket a molekulákat fel is fedezték izraeli és japán kutatók, akik endokannabinoidoknak nevezték el őket. Mi azokkal az enzimekkel kezdtünk el foglalkozni, amelyek ezeket az endokannabionid jelmolekulákat készítik, vagy lebontják. Az volt a célunk, hogy évtizednyi munka alatt felderítsük, hogy néz ki a szinapszisokban az endokannabinoid jelpálya molekuláris szerveződése, bizonyos betegségekben (például epilepsziában, az autizmus bizonyos modelljeiben) ez hogyan változik meg.
Igen ám, de a biokémikusok közben szorgosan dolgoztak, és számos olyan rokonenzimet és rokonreceptort találtak, amiről csak annyit lehetett tudni, hogy léteznek, benne vannak a genomunkban az őket kódoló szekvenciák, és kémcsőben potenciálisan lipid jellegű endokannabinoid jelmolekulákat tudnák készíteni. Azon gondolkoztunk, hogy a biológiailag fontos jelenségeknek a nagy részénél – mint például a szinaptikus erősség megváltozása (szinaptikus plaszticitás), ami fontos a tanulásban – a legfontosabb molekuláris szereplőket a kétezres évek elejére feltárták. Az volt az optimista reményünk, hogy ha ezekkel az új fehérjékkel elkezdünk foglalkozni, akkor ezeknek valami olyan jelenségben betöltött szerepét ismerhetjük meg, amelyet igazából még nagyon mélyen nem ismerünk, vagy esetleg valami új jelenséget sikerül találnunk, s ezzel a munkánknak szélesebb hatása is lesz. Az ERC-pályázatomban arra kértem támogatást, hogy ezekkel a fehérjékkel foglalkozzunk. Ez 4-5 olyan enzimet jelent, amelyek endokannabionoid molekulákat készítenek, lebontanak, valamint olyan receptorokat, amelyeket hasonló hatóanyagok aktiválnak, mint a belső endokannabinoid molekulák.

Téged alapvetően az idegrendszer működésének különböző aspektusai érdekelnek, de amivel korábban foglalkoztál, az nem az idegrendszer fejlődésének korai aspektusa volt, hanem például az, hogy THC hatására hogyan változhat meg ezeknek a receptoroknak az eloszlása az idegsejteken, és legutóbb is arról beszéltünk, hogy ez a jelenség fontos érv lehet a rendszeres kannabiszfogyasztás ellen: folyamatos változás alatt lesz így az agy, aminek a következtében az egésznek a működése megváltozhat. Az egyik kollaborációban született közleményetekben a közelmúltban már hátrébb léptetek, és azt vizsgáltátok, hogy mi lehet ennek a hatása a fejlődő, magzati agyra. Tudnál erről mondani néhány szót?
Ez nagyon érdekes, és bízom benne, hogy fontos munka volt. Amikor 2015-ben Dudok Barna és Barna László agykutatókkal a szuperrezolúciós mikroszkóp segítségével leírtuk, hogy eltűnnek bizonyos idegvégződések végéről a kannabinoidreceptorok a THC-fogyasztás hatására, akkoriban indult be igazán a legalizációs folyamat az Egyesült Államokban és más országokban is. Nagyon büszkék voltunk, hogy még az amerikai Kongresszusban is hivatkoztak erre a tanulmányunkra, hogy azért az kétértelmű, hogy ez teljesen biztonságos anyag lenne, mert nem lehet teljes bizonyossággal megjósolni, hogy kinek a szinapszisaival mit fog csinálni egy adott dózis.
A legalizációs törekvések közepette nagyon érdekes jelenség alakult ki a társadalomban: a kannabisznak már ötezer éve leírták a hányáscsillapító hatását még az egyik kínai császár idejében. A társadalmi elfogadottsággal párhuzamosan mindenféle kismamahonlapokon elkezdett megjelenni az az információ, hogy a terhes kismamáknak a reggeli rosszullétek csillapításában a THC és más kannabiszszármazékok nagyon hasznosak lehetnek. Ez így is van, ugyanakkor a hosszú távú követéses vizsgálatokból már 20-30 éve lehetett sejteni, hogy a rendszeresen nagy dózisban füvet szívó édesanyák gyerekei közt nagyobb arányban lesznek olyanok, akik valamilyen mentális problémával, neuropszichiátriai rendellenességgel küzdenek. De hogy mi ennek a neurobiológiai alapja, arról pontos információink nem voltak. Egy olasz kutatócsoporttal kollaboráltunk, akik már annak idején is segítettek nekünk a THC-s kísérleteknél. Nálunk Budapesten a laboratóriumban nincs THC, ezeket a kezeléseket Olaszországban végezték, mi csak megkaptuk a számkóddal ellátott mintákat, és lemértük őket. Amikor megvolt az eredmény, együtt feltörtük a kódot, és akkor kiderült, hogy mennyire látványos a hatás. Olasz kollégáink az úgynevezett dopaminrendszernek a nagyon elismert kutatói, és már régóta vizsgálták a THC hatását felnőtt modell rendszerekben. Velük, illetve egy amerikai csoporttal kezdtünk el együtt gondolkozni és dolgozni, és kaptunk egy amerikai pályázatot is a National Institute of Health-től, hogy megvizsgáljuk, mi a hatása az anyai THC-nak a fejlődő utódegereknek a neuronhálózataira, és főleg a dopaminrendszerre fókuszáltunk, ami egyébként a mentális egészségünk egyik kulcsszereplője.
Az olasz kollégák nagyon-nagyon érdekes eredményre jutottak: azt találták, hogy első ránézésre a kezelt anyáktól származó egereknek nincs feltűnő bajuk, a dopaminszintjük is megegyezik a kontrollegerekével, viszont ha valamilyen kihívás érte az egereket, a fejlődő idegrendszert stressz érte (például kannabisszal találkozott „kamaszkorban”), akkor több dopamin szabadult fel. Vagyis alapállapotban nincs különbség, de túlingerelhető a dopaminrendszerük, és utána már viselkedésbeli különbségeket is lehet találni.
Mi Budapesten azt vizsgáltuk, hogy mi történik ezeknek a dopaminerg sejteknek a működésével, és kiderült, hogy nagyon jellegzetes szinaptikus változások történnek, amelyek érzékenyítik ezt a rendszert. Ezzel neurobiológiai magyarázatot adtunk arra, hogy mi áll a korábban már leírt jelenség háttérében.
Mondhatjuk, hogy egy genetikai prediszpozíció döntheti el, kiben látunk hatást? Vagyis nem mindenkiben, de (egyelőre) azt sem tudjuk megmondani, hogy kiben igen, és milyen környezeti okok következtében jelenhet meg.
Igen, hatalmas sokféleségünk van, ami valószínűleg nem véletlen egy csoportban élő faj esetében. Nekem, tudod, régi vesszőparipám, hogy vajon például hiúzokban is látnánk-e akkora sokféleséget, mint az emberekben. Ez a sokféleség ugyanis minden egyes pszichiátriai rendellenességben és a kábítószerekre való érzékenységben is jelentkezik, de nyilván ezt eltolhatjuk. Akinek már eleve van genetikai hajlama valamilyen lelki betegségre, és az idegrendszerét még tovább „elhangolja” valamilyen kémiai anyaggal, az sokkal nagyobb kockázatot vállal.
Ha valaki felületesen nézné ezt a korábbi publikációt, illetve a mostanit, ami nemrég jött ki, a Nature Communications nevű lapban, akkor arra a következtetésre juthat, hogy titeket nagyon-nagyon elkezdett érdekelni a fejlődő agy. Ugyanakkor ha az ember ismeri a tudományos megismerést, akkor tudja, hogy egy cikk nem mindig tükrözi időrendben, hogy hogyan jöttek az eredmények. A mostani publikációban leírtok egy olyan mechanizmust, ami megmagyarázhatja a magzati alkohol szindrómát, vagyis azt, hogy mi történik a magzatok fejlődő idegrendszerével, ha az édesanyák túl sok alkoholt fogyasztanak. De ez a sztori is valahogy az endokannabinoid-kutatásból nőtte ki magát.
Nagyon szépen átlátsz a szitán, mert a véletlennek itt nagyon sok szerepe van. Az eredeti célkitűzés a projektben az volt, hogy egy enzimnek, az ABHD4-nek – amiről csak annyit tudtunk, hogy potenciálisan kémcsőben endokannabinoidokat tud készíteni – megvizsgáljuk az élettani jelentőségét. Az ERC-pályázatomban azt ígértem meg, hogy a felnőtt agyban megpróbáljuk kitalálni, bizonyos (utólag hibásnak bizonyuló) előkísérletek alapján, hogy az idegsejtek dendritnyúlványaiban milyen szerepe lehet az ABHD4-nek. Amikor beszereztük a munkához szükséges eszközöket és vegyszereket, egértörzseket, akkor kiderült, hogy ez az elgondolás zsákutca, és több év elment arra, hogy megpróbáljuk megfejteni, a felnőtt idegrendszerben mit csinál ez az enzim. De nem találtuk az enzimet, pedig mindent megpróbáltunk. Én sztereotip gondolkodással ragaszkodtam hozzá, hogy biztos csak valami anyag nem jó, vagy mi nem vagyunk elég ügyesek. A biológiában nehéz kijelenteni egy negatív eredményre, hogy tényleg negatív – a bizonyíték hiánya nem bizonyíték a hiányra. Viszont Lele Zsolt kollégám, aki akkoriban csatlakozott a csoporthoz, fejlődésneurobiológus, és igazából az ő ötlete volt, hogy ha itt van ez az enzim, ami az evolúció során viszonylag konzerválódott, akkor annak valami fontos szerepe kell legyen. És ha a felnőtt idegrendszerben nincs meg, akkor az embrionális idegrendszerben kell keresni, mert máshol nem lehet.
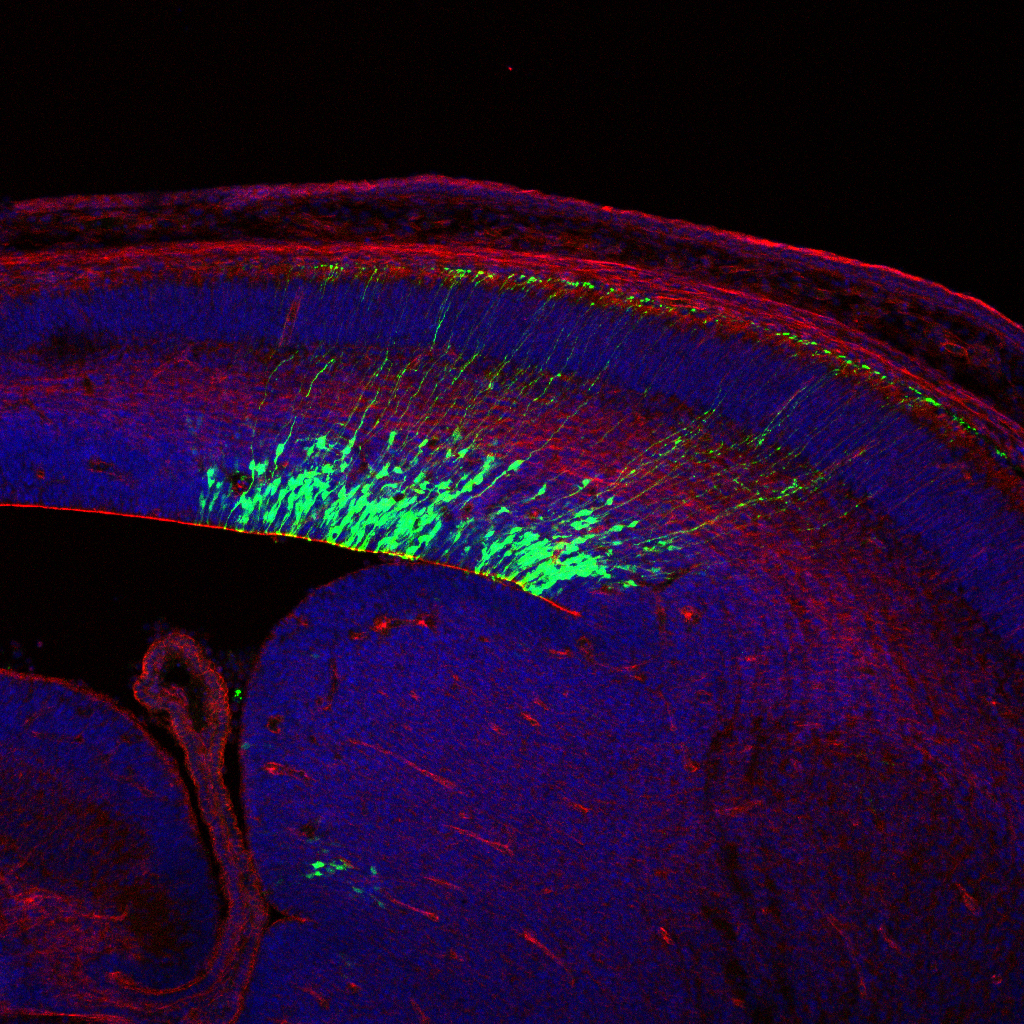
A kutatók a pályafutásuk során átélhetnek „heuréka pillanatokat”, ami miatt szenvedélybetegek lesznek a tudományos kutatás iránt, és amikor Zsolt elkészítette az embrionális egéragyból a metszeteket, az ilyen pillanat volt. Azt találta, hogy az embrionális egéragyban rengeteg ABHD4 enzim van, vagyis kiderült, hogy a fejlődés során játszik fontos szerepet ez az enzimfehérje. Már a kifejeződésének a mintázata is nagyon érdekes volt, hiszen nem minden sejtben van jelen, hanem csak egy különleges sejttípusban, őssejtekben, amelyek az agykamrák falában találhatók. Ezekből a progenitor sejtekből több millió van, osztódnak, és belőlük születnek az idegsejtek, illetve az ezeket körbeölelő gliasejtek. Mindez nagyon izgalmas volt, hiszen arra utalt, hogy ezeknek a progenitorsejteknek a működésében játszik fontos szerepet ez az eddig ismeretlen feladatú enzim.
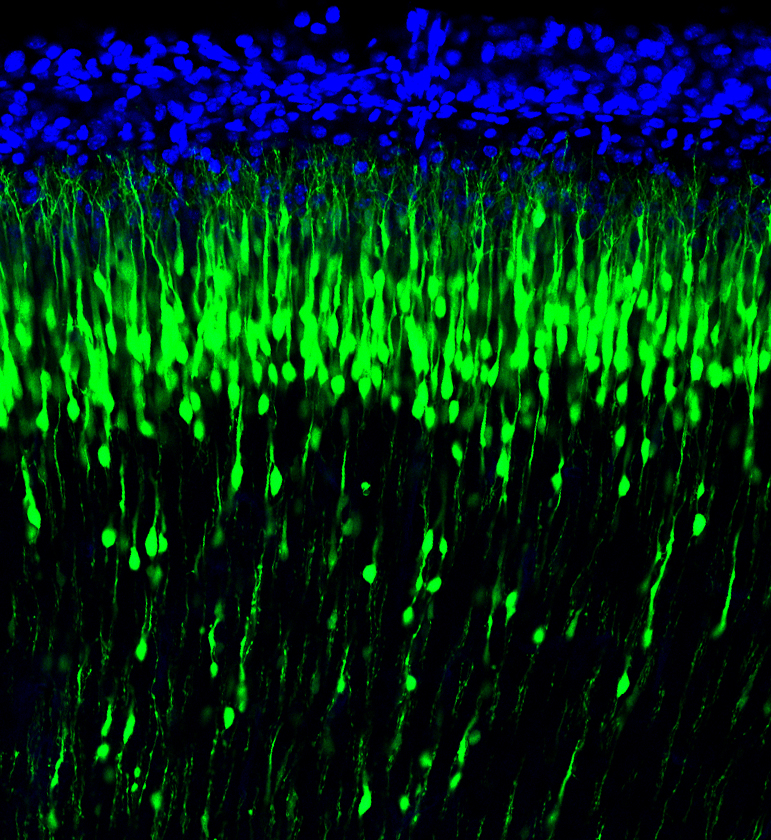
Ezek a szakirodalomban radiális gliaként ismert progenitor sejtek időről időre osztódnak a fejlődő agyban, és általában legalább az egyik utódsejtjük elkezd differenciálódni. Amit az eredményeitek mutattak, érdekes módon az, hogy az újonnan születő, differenciálódó sejtekben megváltozik az ABHD4 expressziója,
Igen, ez nagyon jó felvetés, hiszen ez volt a kulcs megint az áttöréshez. Az expresszió felfedezése után egy ideig megint zsákutcákban topogtunk, legjobb akaratunk és a sok munka ellenére. Szentgyörgyi Albertnek van az a híres mondása, hogy a struktúra meg a funkció igazából ugyanannak az érmének a két oldala, és ha nem figyeljük meg valaminek a szerkezetét, akkor a funkcióját sem fogjuk igazán megérteni. Mi itt úgy gondolkodtunk, hogy ha az ABHD4-nek az őssejtekben van szerepe, mert ezekben termelődik, akkor meg kellene nézni azt a két tankönyvi funkciót, ami ezekkel a sejtekkel kapcsolatban ismert. Ezért megnéztük, hogy az ABHD4 hiányában vajon mi történik a sejtosztódással. És kiderült, hogy semmi baja nincs a sejtosztódásnak. Utána azt vizsgáltuk, hogy mi történik a sejteknek a hosszú nyúlványával, ami átéri az agykérget, és gyakorlatilag létraként szolgál az újonnan születő idegsejtek számára, hogy megkeressék és elérjék az agykéregben azt a pozíciót, ahol majd a feladatát betölti. Kiderült, hogy ennek a „létrának” sincs semmi baja. Vagyis ezeknek a sejteknek a két tankönyvi funkcióját nem befolyásolta az ABHD4 hiánya, és nehéz kérdés volt, hogy akkor vajon miért termelnek ilyen sokat ebből az enzimből.
Ekkor arra gondoltunk, hogy lehet, fordítva kellene feltenni a kérdést, és azon kezdtünk el gondolkozni, hogy a mikroszkópos képek alapján az újszülött idegsejtekből eltűnik ez a fehérje, ami arra utal, hogy ezeknek az idegsejteknek nincs szükségük rá. De mi lenne akkor, ha megpróbálnánk visszarakni beléjük az enzimet? Technikailag bonyolult kísérletekkel László Zsófia és Lele Zsolt kollégáim ezt megvalósították. Nagyon-nagyon izgalmas eredményt láttunk – ez volt a következő „heuréka pillanat” – ugyanis azok a sejtek, amelyekben megmaradt az ABHD4, megtorpantak, nem voltak képesek a helyükre vándorolni, majd kicsivel később legömbölyödtek, elvesztették a nyúlványaikat, és végül elpusztultak. Ez arra utalt, hogy az ABHD4 enzim a sejteknek valamiért nem jó, nem véletlen, hogy a fejlődő idegsejtek lekapcsolják, és potenciálisan a sejthalálban is fontos lehet. Egy másik rendszeren Mógor Fruzsina azt is megvizsgálta, hogy mi történik, ha olyan sejteknek adjuk az ABHD4-et, amelyeket egyébként nagyon-nagyon nehéz elpusztítani – itt is kilencszeresére emelte a sejthalál mértékét az enzim.
Innentől nagyon-nagyon izgalmas lett a projekt, hiszen a fejlődő idegrendszerben a sejthalál alapvető jelenség. Azt becsülik, hogy körülbelül kétszer annyi idegsejtünk születik, mint ami végül megmarad felnőtt korunkra, de nagyon precízen szabályozott, hogy különböző sejttípusok mikor, milyen aktivitás hatására pusztulnak el.
Egy gyors kérdést vetnék közbe. A folyamat, amit leírtatok, nem a sejthalál szokványos formája. Még 2002-ben Nobel-díjjal jutalmazták azokat a kutatókat, akik leírták azokat a géneket, amelyek a programozott sejthalálért felelősek. Ezt ők egy Caenorhabditis elegans nevű fonalféregben írták le, ahol nagyon jól meghatározott szinte minden sejt esetében, hogy az hogyan fog létrejönni. A folyamat, amit ti leírtok, azért nem ennyire programozott. A sejthalálnak is több verziója van, az általatok leírt abban különleges, hogy egy rendszernek robusztusságot ad. Nem minden idegsejtnek kell elpusztulnia, de néhány, ami nem felel meg valamilyen lényeges kritériumnak, el fog pusztulni.
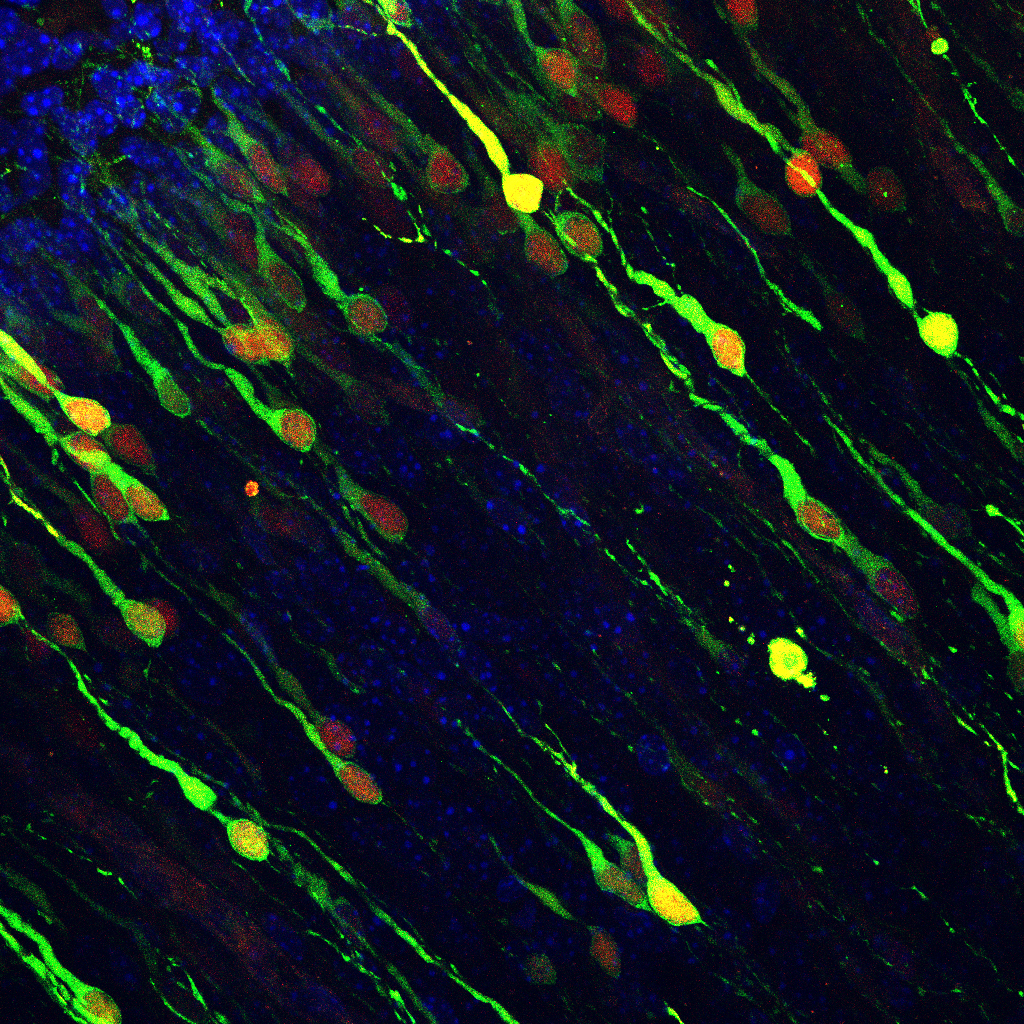
Igen, pont ez volt a következő nagy meglepetés, amikor az alapszintű sejthalált vizsgáltuk. Ugyanis nem volt alapból különbség a kontroll- és ABHD4-et nem kifejező egerek között a sejthalálban. De itt jött megint elő Lele Zsolt kollégám fejlődés-neurobiológus múltja (és ez is jó bizonyíték arra, hogy a modern élettudományokban már csapatokban érdemes dolgozni). Zsolt korábban cadherin fehérjékkel dolgozott, amelyek az egymás melletti sejteket molekuláris kapcsokként összehorgonyozzák. Az agykamrák falában ez a több millió őssejt nagyon szoros cadherin kapcsokkal kapcsolódott, és Zsolt korábbi tapasztalatait felhasználva meg tudtuk vizsgálni, hogy mi történik, ha elrontjuk ezeket a cadherin kapcsokat.
Oldalirányba kanyarodva azt érdemes megemlíteni, hogy a szöveti mikrokörnyezetben a sejtjeink a szomszédos sejtekkel nagyon precízen kapcsolódnak. Viszont ha valamelyik sejtnek valami baja van, megsérül, beteg, akkor ezek a kapcsolatok lebomlanak, a sejt kikerül a mikrokörnyezetéből, és elpusztul. Ez a jelenség egy különleges sejthalál-típus, az anoikis, ami otthontalanságot jelent. Az anoikis körülbelül 1994 óta ismert volt a sejtbiológiában, de főleg a rákkutatásban vizsgálták, ugyanis az elmúlt években kiderült, hogy a daganatos sejtek úgy képeznek áttétet, hogy ez elől a sejthalál elől képesek megszökni. És egy őssejtnek, ami kikerül a szöveti mikrokörnyezetéből, szintén el kell pusztulnia, mert ha nem pusztul el, akkor képessé válik arra, hogy elvándoroljon, és egy távolabbi szövetben tovább osztódjon, akár daganat kialakulását is okozva.
Az idegrendszer biológiájában eléggé kevéssé kutatott téma, hogy amikor több millió idegi őssejt van az agykamrák falában, azért várható, hogy néha véletlenszerűen is kiszakadnak ezek a radiális glia progenitor sejtek, hiszen az ő osztódásaikkal több milliárd sejt keletkezhet, több milliárd sejtosztódás révén. Ennyi osztódásnál pedig elkerülhetetlen, hogy legyenek olyan hibás, radiális glia sejtek, amelyek nem maradnak bent az agykamra falában az osztódás után. Ez pedig kóros elváltozásokhoz, a legrosszabb esetben agydaganatok kialakulásához vezethet.
Ahhoz képest, hogy itt csillagászati számokról van szó, az ilyen betegségeknek az aránya a populációban meglehetősen kicsi. Ezért kezdtünk gondolkozni azon, hogy mi van akkor, ha létezik olyan védekező mechanizmus, aminek az a feladata, hogy ezeket a véletlenszerű, sporadikus hibákat kiküszöbölje. És mi van akkor, ha ez a mechanizmus olyan feladatot is betölt, hogy a fejlődő idegrendszert érintő káros környezeti hatások nyomán kikerülő őssejtek ne tudjanak elvándorolni és másutt osztódni.
És itt jön az alkoholos befolyásoltság a képbe, ha jól sejtem.
Így van. Zsófi ötlete alapján kiválasztottuk az alkoholt, mert ennek van a legismertebb, idegrendszeri problémákat is okozó magzatkárosító hatása. (Bár a legkönnyebben elkerülhető is, hiszen ha az édesanya nem fogyaszt alkoholt, akkor nem lesz fejlődési zavar emiatt a csecsemőben.) Régóta ismert, hogy az alkoholista édesanyák gyerekei kisebb fejjel születnek, és kisebb a születési testsúlyuk. Valamint ismert volt korábban, hogy az alkohol képes elpusztítani az őssejteket, így ez nagyon jó modellnek tűnt, hogy megnézzük van-e az ABHD4 enzimnek szerepe a folyamatban. Az eredmények azt mutatták, hogy
az alkohol hatására valóban megemelkedik az elpusztult radiális glia progenitor sejtek száma, ugyanakkor ABHD4 hiányában nem tapasztaltunk sejthalált. Vagyis ez a fehérje valóban nemcsak a véletlenszerű osztódási hibák, hanem a potenciálisan károsító környezeti hatások kivédésben is fontos szerepet játszik.
Hány fajta stresszor esetében sejthetjük ennek a folyamatnak a szerepét? Például vannak a közelmúltban nagyobb figyelmet kapó mikrokefáliás megbetegedések, mint a Zika-vírus által kiváltott mikrokefália – bár ott az egyik fontos dolog, hogy a vírus hatására hamarabb megáll a progenitor sejtek osztódása, de ott is ismert az erőteljes sejthalál jelensége is. Lehet itt is szerepe az ABHD4-nek?
Ezen sokat gondolkoztunk, hogy miképp tudnánk vizsgálni, de nem találtunk a közelben olyan kollégát, akinek beállított Zika-vírus-modellje lenne. De ez abszolút releváns hipotézis, és nagyon izgalmas lenne megnézni.
Nem bírom megállni, hogy a fejlődésbiológus ne törjön elő belőlem: az utóbbi időben nagyon felkapott lett az agyi organoidokon való kutatás, ami felgyorsíthatja a kutató munkát. Gondoltatok arra, hogy ilyen organoid – akár humán organoid – rendszerben is vizsgálnátok ennek az enzimnek a funkcióját?
Igen, ez izgalmas kutatási irány, és mindenféle adatbázisokban már elérhető, hogy ilyen organoidokban ez az enzim milyen sejtekben van bekapcsolva, és azok ugyanazt mutatják, mint amit mi találtunk, azaz elsősorban a radiális glia sejtekben van jelen az ABHD4. Szeretnénk ezt a rendszert beállítani az itthoni laboratóriumunkban is, de azért ezek nem teljesen triviális kísérletek. Persze rengeteg előnye van, ha Petri-csészében tudunk szervmodellt vizsgálni, és sok kísérletet biztos így lesz érdemes elvégezni.
Utolsó kérdésként, hogy kerekítsük vissza a történetet oda, ahonnan tulajdonképpen elindultunk: mondhatjuk-e, hogy ez a legfrissebb munkátok, akárcsak a korábbiak, azt hangsúlyozza, hogy ugyan van egyfajta robusztusság az idegrendszer fejlődésében és működésében, de – ha lehet így fogalmazni – ezt nem kell a végletekig feszíteni, mert van az a pont, ahol a kompenzációs mechanizmusok már nem lesznek elegendőek?
Én biológusként főleg a szinapszisokat kutattam a pályám nagy részében, és ami a szinapszisokkal kapcsolatban gyönyörű, hogy minden egyes szinapszisunkban, ezredmásodperc pontossággal, néha akár pikoamper pontossággal van beállítva, hogy milyen áramokkal beszélgetnek egymással az idegsejtek. Most, amikor mi beszélgetünk egymással, pár tízezer idegsejtemben ezek a szinpaszisok az ezredmásodperces skálán a pikoamperes áramokkal működnek. Ezek nem véletlenül vannak így beállítva. Az én személyes véleményem minden olyan anyaggal kapcsolatban, ami masszívan befolyásolja az idegsejtek működését az, hogy az ember jobb, ha elkerüli őket. Mert ezeket a szinapszisokat, amelyek mi és az emlékeink vagyunk valahol, az ember nem akarja befolyásolni. És ezek a finomhangolások valószínűleg sokkal fontosabbak, mint ahogy azt gondoljuk. Emiatt, főleg egy fejlődő idegrendszer estében én óvatos lennék, hogy bármi elhangolja azt.
Kapcsolódó cikkek a Qubiten:

Hétköznapi semmiségnek tűnik, mégis életveszélyes betegségeket okoz a gyulladás
A nyugati civilizáció tipikus betegségeinek sokszor krónikus gyulladás áll a hátterében, de azt is lehet tudni, hogy a gyulladásgátlás bizonyos fajtái az egészségesekben is fokozzák az idegrendszer rugalmasságát, növelik a kreatív teljesítményt. Magyar kutatók azt vizsgálják, milyen szerepe lehet a kannabisznak a gyulladás csökkentésében, míg a Szilícium-völgy technokratái már marihuánából készült turmixszal kúrálják magukat.

Ausztriában és Csehországban rég legális, a magyar doktorok viszont fel sem merik írni az orvosi marihuánát
Világszerte egyre több helyen engedélyezik a kannabisz gyógyászati használatát, de Magyarországon nagy tortúra árán sem jut hozzá szinte senki legálisan a szerekhez. A biztató kutatások ellenére a tudomány még messze áll attól, hogy kiaknázza a növény teljes gyógyító potenciálját.