Mesterséges intelligenciával azonosították a herpeszvírusok gyenge pontját

Molekuláris szimulációkkal és gépi tanulási algoritmussal tárták fel kutatók, hogy mi kell ahhoz, hogy a herpeszvírusok megfertőzzék sejtjeinket – ami a jövőben új antivirális terápiák kifejlesztésének ágyazhat meg.
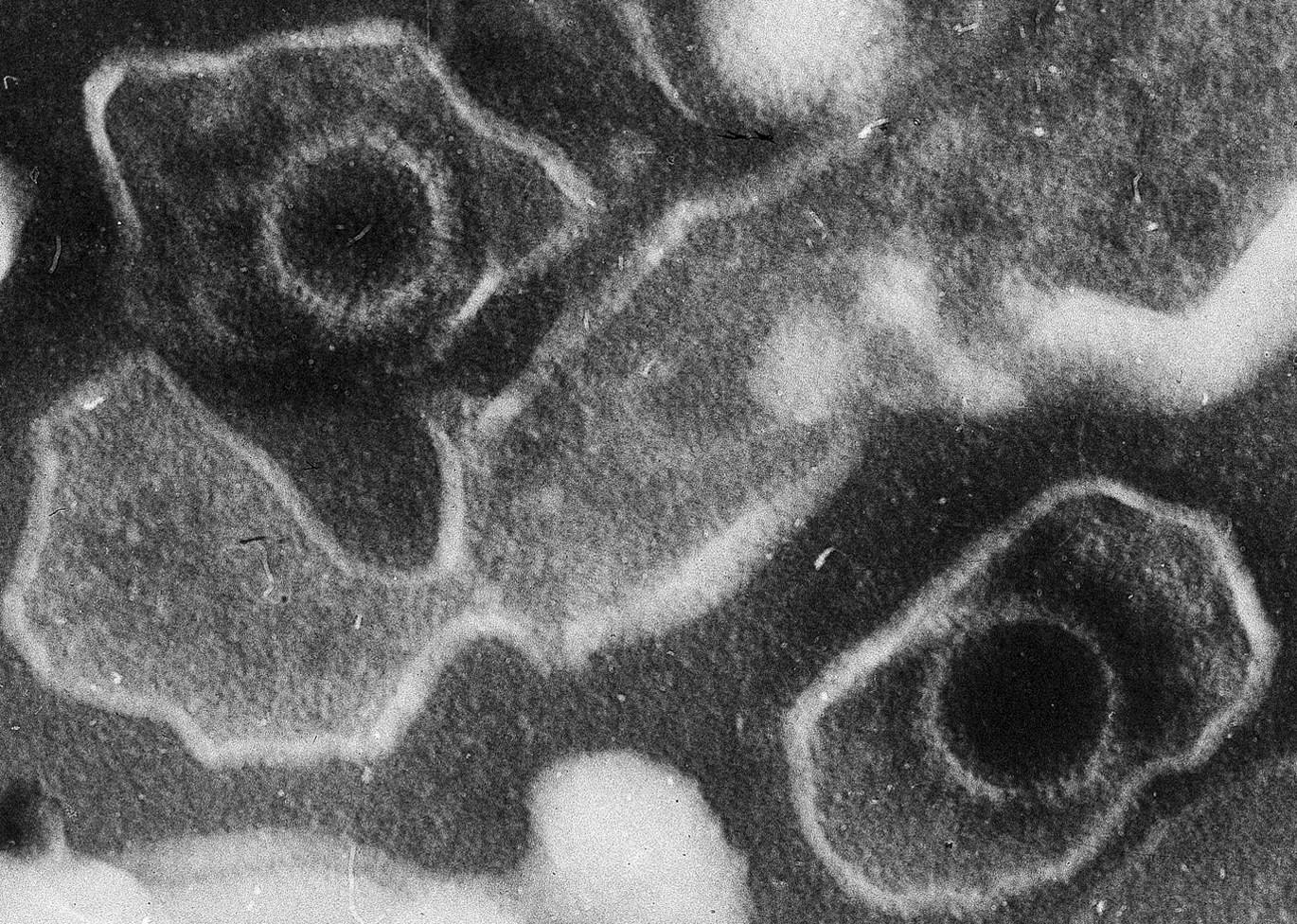
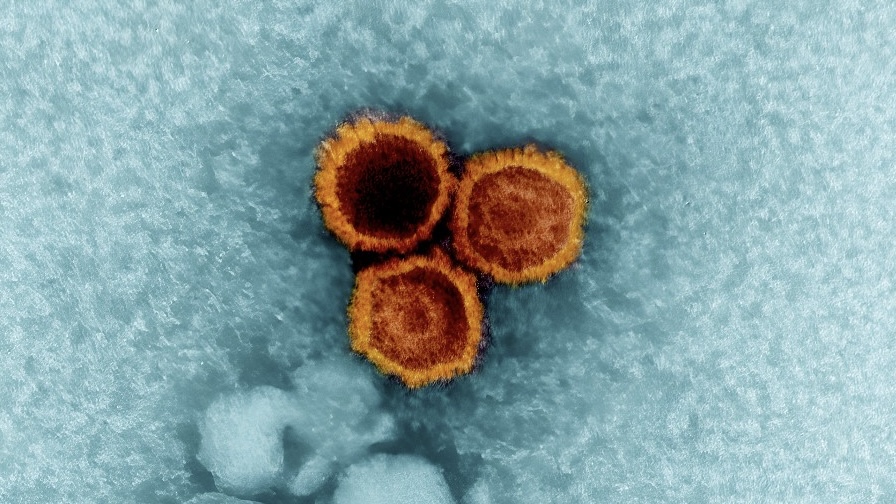
Jin Liu, a Washingtoni Állami Egyetem professzora és kollégái egy rejtett molekuláris stabilizátorra bukkantak a herpeszvírusok egyik fehérjében, ami elengedhetetlen a fertőzés kialakulásához. A herpeszvírusok közé tartozik többek közt a bárányhimlőért és övsömörért felelős varicella-zoster vírus (VZV), valamint a sclerosis multiplex és a lupusz kiváltásához kötött Epstein-Barr-vírus (EBV).
A kutatók a Nanoscale folyóiratban novemberben közölt tanulmányuk szerint a glikoprotein B (gB) fúziós fehérjét vizsgálták. Ez a fehérje a vírus sejtbe jutásakor jelentős szerkezeti átalakuláson esik át (úgynevezett pre-fúziós konformációból poszt-fúziós konformációba), aminek köszönhetően lehetővé teszi a vírus sejtmembránnal történő fúzióját.
A kutatók olyan, a gB fehérjén belüli kölcsönhatásokat kívántak felderíteni, amik a sejtmembránnal történő találkozás előtt stabilizálják a molekula szerkezetét, hogy aztán létrejöhessen a sejtmembránnal történő fúzió és a vírus bejuthasson a sejtbe. Molekuláris szimulációk és egy gépi tanulási algoritmus segítségével ezután rátaláltak arra az aminosavak közötti kölcsönhatásra, ami kulcsszerepet játszik a gB fehérje pre-fúziós szerkezetének stabilizálásában.
„A vírusok nagyon okosak” – mondta Liu. – A sejtek megfertőzésének folyamata rendkívül összetett és sok [molekuláris] kölcsönhatást igényel. Ezek közül nem mindegyik egyformán fontos, a legtöbb csak háttérzaj lehet, de vannak köztük kulcsfontosságúak”.
Ezután megnézték, hogy mi történik, ha egy aminosav módosításával elrontják a szimulációk és gépi tanulási algoritmus által azonosított, Q181 és R747 aminosavak között fennálló stabilizáló kölcsönhatást. Laboratóriumi kísérletek feltárták, hogy a Q181 aminosav módosítása teljesen meggátolta a fehérje működését, ami valószínűleg a vírus sejtbe jutását is ellehetetleníti.
„Ez egyetlen kölcsönhatás volt több ezer közül. Ha nem végezzük el a szimulációkat, és próba szerencse alapon folytatjuk a kísérleteket, évekbe telt volna ezt megtalálni. Az elméleti számítási munka kísérletekkel történő kombinálása nagyon hatékony és fel tudja gyorsítani ezeknek a fontos biológiai kölcsönhatásoknak a feltárását” – mondta Liu. A kutatók a következő években azt szeretnék tovább vizsgálni, hogy miként hat pontosan a vírusfehérjére az aminosav módosítása.