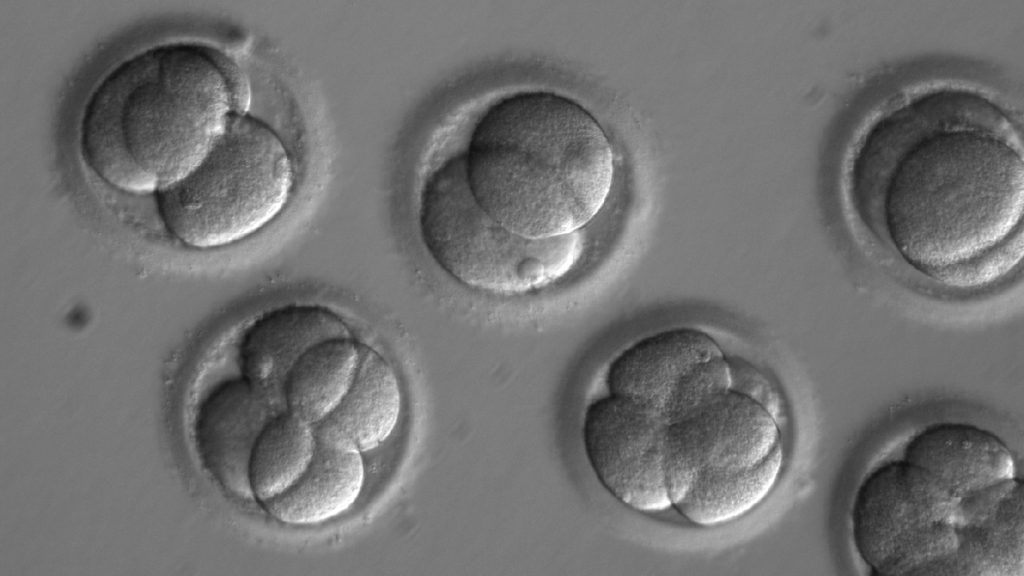
A génszerkesztés túl kiszámíthatatlan eredményre vezet ahhoz, hogy öröklődő betegségek gyógyítására használják

„A természetet, mint a boszorkányokat, kínpadra kell feszíteni, hogy kipréseljük belőle titkait” – vélte Francis Bacon, a kísérleti természettudomány egyik atyja. A 17. században megszülető nyugati tudomány azóta megszelídült, etikai érvekkel akarja alátámasztani a kísérletezést. A Nature által június végén bemutatott három vizsgálat neves genetikus szerzői azonban arra a következtetésre jutnak, hogy mivel a technológia megjósolhatatlan eredményre vezet, öröklődő betegségek gyógyítása céljából etikátlan génszerkesztést végezni.
Kathy Niakan és munkatársai, a londoni biomedikai kutatóközpont, a Francis Crick Intézet kutatói CRISPR–Cas9 technológiával mutációt alakítottak ki egy embrionális fejlődéshez szükséges génben (POU5F1), azonban a beavatkozás a sejtek 22 százaléka esetében a megváltoztatni kívánt rövidke DNS-szakasz közelében (on-target hatás) hatalmas genetikai anyag elvesztését és további méretes DNS-szakaszok hibás beilleszkedését eredményezte.
Ha egy beavatkozás csak néha sikerül, megkérdőjeleződik az egész módszer etikája, azonban ez a tanulmány nem gyógyítással foglalkozik, kommentálta a londoniak eredményét Varga Máté, az ELTE genetikusa. Ez alapkutatás, amiben arra voltak kíváncsiak, hogyan fejlődik a korai emberi embrió. Hiába tudunk ugyanis sokat a korai egérembrióról, ha a korai humán embrióról alig, márpedig a géneditálás kimenete fajfüggő is lehet. Varga szerint ennek a vizsgálatnak az volt a célja, hogy megértsük, miként folyik az ember embrionális fejlődése, és rájöjjünk, milyen tényezők magyarázzák, hogy a koncepcióknak csak kevés százalékából lesz terhesség természetes esetben is. A kutató szerint jelenleg nem tudjuk, hogy az emberi embrió miért olyan sérülékeny az elején; ezt máshogy nem lehet megérteni, mint hogy elrontunk géneket, és vizsgáljuk a hatást, vagyis ennek a fajta kutatásnak Varga szerint igenis van létjogosultsága.
Gyorsan osztódó zebrahal
A második Nature által idézett vizsgálatban a New York-i Columbia Egyetem őssejtbiológusai Dieter Egli vezetésével egy mutációt hordozó spermiummal hoztak létre embriót (itt az EYS génben volt vakságot okozó hiba). A CRISPR–Cas9-cel történő hibajavítási próbálkozás révén az esetek felében elveszett a módosított kromoszóma nagy része, időnként pedig az egész. Tanulmányukban a kutatók felhívják a figyelmet: jelenleg arra sem vagyunk képesek, hogy pontosan megkülönböztessük a sikeresen editált embriókat a sérültektől.
A génszerkesztés eredménye függ attól is, hogy mikor végezzük a javító célú beavatkozást, a megtermékenyítéssel együtt vagy később; ez utóbbi esetben nagyobb a mozaicizmus esélye, amikor eltérő genetikai anyagot tartalmazó sejtekből álló embrió alakul ki, mondta Varga, aki zebrahalembriókon vizsgálja a technológiát. A zebrahalaknál nagy különbség, hogy igen gyorsan osztódnak: hiába injektálják a kutatók a spermiummal egyszerre a génszerkesztő eszközt a petesejtbe, mire befejezik az injektálást, a zebrahalembrió már kétsejtes állapotban van. Az emberi embriók lassabban osztódnak, valószínűleg van idő a DNS-kettőslánc elhasítására és a javításra az első osztódás előtt. Azonban a génszerkesztés minden egyes targetált régiónál, minden célba vett génnél máshogy működik, és egyelőre csak egy-egy gén esetében van ezzel kapcsolatos tudásunk. Míg mindhárom cikk egyetlen gén módosításának hatását vizsgálta, az embernek kb. 23 ezer génje van.
Gyanús génkonverzió
Varga szerint a harmadik idézett tanulmány, ami egy 2017-es Nature-cikk folytatása, egy meglehetősen különutas hipotézist próbál alátámasztani. Az Oregoni Egyetem reproduktív biológusai Shoukhrat Mitalipov vezetésével szívizomdisztrófia-mutációt hordozó spermiummal megtermékenyített petesejtet kezeltek CRISPR–Cas9-cel, és ők is rengeteg szándékolatlan hibát találtak a szerkesztett embriókban, viszont a 40 százalékban előforduló pontos szerkesztést egy olyan mechanizmussal. a génkonverzióval magyarázzák, amikor a hibajavítás nem a bejuttatott szintetikus templátról, hanem a petesejt kromoszómájának egészséges homológ génjéről történik. A génkonverzióhoz azonban az kellene, hogy az apai és az anyai kromoszóma fizikailag elég közel legyen egymáshoz, a megtermékenyített humán petesejtben viszont ez sokáig nincs így, ezért bírálták sokan a szerzők három évvel ezelőtti cikkét is. Varga szerint hangsúlyozni kell, hogy akár a másik kettő, ez a harmadik tanulmány is preprint, vagyis még nem esett át a szakmai ellenőrzésen, és a szakemberek még sokat fognak rágódni ezen a magyarázaton. Az azonban bizonyos, hogy ez a három humán csíravonal-szerkesztési tanulmány megerősíti, amit eddig is sejtettünk: egyelőre olyan keveset tudunk, hogy egyelőre mindenképpen várni kell a technológia gyógyászati felhasználásával, és az alapkutatásra érdemes koncentrálni.
Titkos tudomány
Az első idézett vizsgálatot vezető Kathy Niakan tavaly egy Rebeka A. Lee-vel közösen írt Nature Cell Biology-cikkben mutatta be a humán csíravonal-szerkesztés tudományának jelen állását, és összeszedte azokat az előfeltételeket, amiknek a legteljesebb szakmai konszenzus szerint érvényesülniük kell ahhoz, hogy a jövőben etikus módon lehessen terápiás céllal emberi csíravonal-, illetve embriószerkesztésbe fogni.
A jelenleg börtönben ülő, elhíresült kínai kutató által létrehozott, szerkesztett, majd anyaméhbe ültetett embriók esetén egyik feltétel sem teljesült. Csienkuj He egy a HIV-vírus terjedéséhez fontos receptor génjét (CCR5) darabolta fel az embriókban CRISPR–Cas9-cel, hogy védetté tegye őket az apai HIV-fertőzéssel szemben. Azonban a HIV-fertőzés kezelésére sokkal biztonságosabb, hatékony módszer is létezik, és a létrehozott inaktiváló mutáció valószínűleg káros (természetesen előforduló formája Észak-Európában fellelhető, máshol nem, ami negatív szelekcióra utal). Ráadásul nem végeztek a biztonságosságot bizonyító preklinikai vizsgálatot, nem volt sem peer review, sem hatósági engedélyezés, és a kínai kutató nem rendelkezett olyan eszközökkel, amelyekkel a módosított embrió sejtjeinek DNS-ét ellenőrizni tudta volna. He az érintett szülőket sem tájékoztatta elég alaposan, továbbá a génszerkesztést nem széles társadalmi konszenzusnak megfelelően és a köz tájékoztatásával végezte – írja Niakan egyébként szintén nem nyilvános, hanem 9 dollárért hozzáférhető írásában, amivel egyúttal arra is emlékeztet, hogy bár a tudomány már nem a kínzás Bacon által leírt metaforája szerint működik, saját alapelveinek betartásában még van hová fejlődnie.
Kapcsolódó cikkek a Qubiten:

Eltűnt a kínai tudós, aki létrehozta a világ első génszerkesztett gyerekeit
Pletykák szerint volt munkahelyén tartják házi őrizetben a közellenséggé vált genetikust, de ezt az egyetem nem kívánta megerősíteni.

Felelőtlen egotrip nyomán születtek a génszerkesztett kínai ikrek, Lulu és Nana
Két hét után többet tudunk az első genomszerkesztett ikerpárról, de minden újabb információ azt látszik alátámasztani, hogy ez a kockázatos és fölösleges beavatkozás csak a kutatást vezető Csienkuj He nagyravágyásáról szól.

Hősök és fenegyerekek, avagy a génszerkesztés etikája
Melyek az emberi génszerkesztés etikai és jogi feltételei, és vajon tudunk-e már eleget ahhoz, hogy ebbe belefoghassunk? Szabad-e egyáltalán egészséges embrión, embereken ilyen beavatkozást pusztán rezisztencia kialakítása miatt végezni? Hogy látja mindezt egy bioetikus?

Jönnek a kimérák és a hibridek, ideje lebontani a genetikai kísérletek 20. századi korlátait
Emberi kimérák mindig is voltak, csak nem tudtunk róluk, de lassan a tudatos létrehozásuk sem tabu már. A közelmúltban számos olyan kutatási és terápiás modell létrehozására kértek engedélyt, amelyben a kimérát vagy a hibridet szándékosan hozzák létre. Itt az ideje, hogy a 21. század biotechnológiai ismeretei alapján tovább cizelláljuk a génállományba való beavatkozás tilalmát.