Engedélyezték az AstraZeneca antitest-készítményét az Egyesült Államokban

Sürgősségi felhasználási engedélyt adott az amerikai Élelmiszer- és Gyógyszerügyi Hatóság (FDA) az AstraZeneca Evusheld nevű készítményének, ami megelőzheti a koronavírus-fertőzést. Az első gyógyszerszállítmányok várhatóan rövidesen elérhetők lesznek.
Az Evusheldet az FDA azoknak a 12 évnél idősebb, 40 kilogrammnál nehezebb serdülőknek és felnőtteknek ajánlja a covid ellen, akiknek
- az egészségi állapotuk vagy az immunrendszerre ható gyógyszeres kezelésük miatt közepes vagy súlyos immunhiányuk van;
- nem alakult ki megfelelő immunválaszuk a koronavírus elleni védőoltás után;
- komoly egészségügyi kockázatot jelentene a védőoltás felvétele.
Az Evusheldet csak azok kaphatják meg, akiknek nincs koronavírus-fertőzése, és a közelmúltban nem érintkeztek fertőzött személlyel.
Az Evusheld két hosszú hatású, módosított monoklonális antitest kombinációja. Ez az egyetlen hasonló készítmény, amit az FDA a koronavírus megelőzésére engedélyezett – egy alkalommal, izomba beadott injekció formájában.
A globális népesség nagyjából 2 százaléka a covid-vakcinák felvétele ellenére is fokozott kockázatnak van kitéve, mert az oltás hatására sem alakul ki bennük megfelelő immunválasz. Magyarországon ez több ezer embert jelenthet, akiknek az Evusheld segíthet a fertőzés elkerülésében. Közéjük tartoznak a rosszindulatú vérképzőszervi betegséggel élők, a kemoterápiával kezelt daganatos betegek, és a szervátültetés után lévők, vagy más immun-csökkentő kezelést kapó betegek – ilyenek például a szklerózis multiplex vagy sokízületi gyulladás miatt alkalmazott terápiák.
Az FDA a PROVENT III-as fázisú klinikai vizsgálat előzetes eredményei alapján hagyta jóvá az Evusheld alkalmazását. A klinikai vizsgálatok során statisztikailag szignifikáns csökkenést mutattak ki a tünetes koronavírus-fertőzés kialakulásában, és a védelem legalább 6 hónapon át fennmaradt. Az FDA döntését a korai farmakokinetikai eredmények és a STORM–CHASER tanulmány adatai is alátámasztották. Biztonsági aggályok nem merültek föl.
Az in vitro eredmények alapján az Evusheld semlegesítheti a közelmúltban felbukkant SARS-CoV-2 vírusvariánsokat, például a delta és mű variánsokat. A laboratóriumi vizsgálatok alapján az omikron variánsban található kötőhely-változások nem problémásak az Evusheld szempontjából.
Az Evusheld engedélyezési eljárása az Európai Unióban is megkezdődött. Az AstraZeneca világszerte több országgal kötött előzetes szállítási megállapodásokat. A készítmény beszerzéséről előrehaladott tárgyalások folynak – többek között – az Európai Unió több tagországával is, de a beszerzésről a helyi hatóságok döntenek.
Kapcsolódó cikkek a Qubiten:
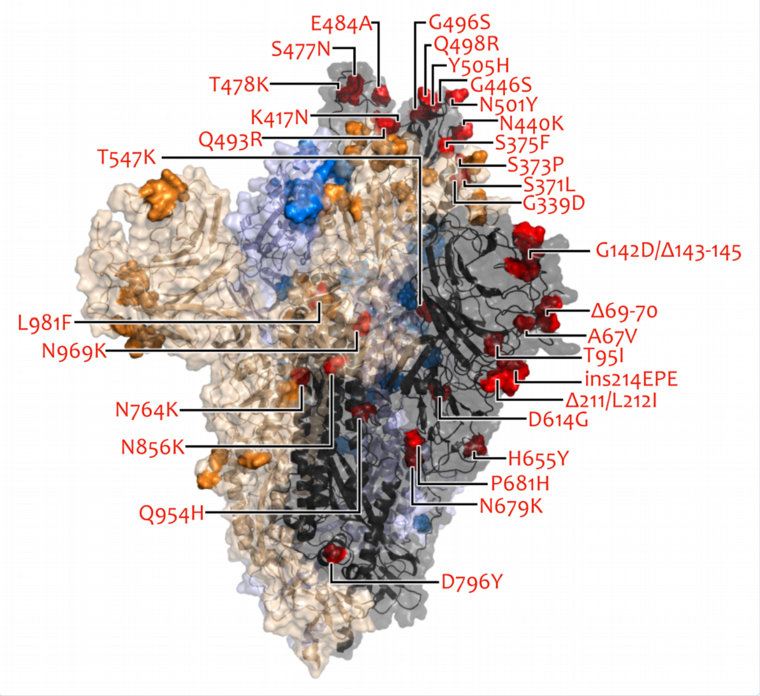
Látványosan sok aggasztó mutációval rendelkezik az omikron, de még nem tudni, milyen lesz az együttes hatásuk
Elképzelhető, hogy az új vírusvariáns egy vagy több immunhiányos betegben, krónikus koronavírus-fertőzés során alakult ki, de az is lehet, hogy újabb zoonózis eredménye, vagyis az emberről egy ismeretlen állatfajra került, és onnan jutott vissza az emberi populációba. Az oltások valószínűleg továbbra is védenek a súlyos betegség ellen, és feltehető, hogy a gyógyszerek hatásossága sem csökken.

Mi haszna a koronavírus elleni oltásnak, ha úgyis elhalványul az immunitás?
A jelenleg uralkodó SARS-CoV-2 vírusvariáns, a delta fertőzőbb, mint az eddigiek, és gyorsabban okozhat súlyosabb tüneteket. Egyre kevésbé látszik, mikor érhet véget a járványhelyzet. Adódik a kérdés: vajon mennyire hatékonyak és mitől védenek meg a vakcinák?
Az AstraZeneca a legolcsóbb, a Sinopharm a legdrágább a vakcina-világpiacon
Argentína, Magyarország vagy Szenegál járt jobban a Sinopharmmal? Dél-Afrika vagy az EU fizet többet egy adag AstraZenecáért? Drágának számít a Moderna nemzetközi összehasonlításban? Megnéztük, mennyit fizetnek az egyes országok a koronavírus elleni oltások egy-egy dózisáért.