Látványosan sok aggasztó mutációval rendelkezik az omikron, de még nem tudni, milyen lesz az együttes hatásuk

Az Egészségügyi Világszervezet, a WHO a múlt hét végén „aggasztó variánsnak” (variant of concern, VOC) nyilvánította a B.1.1.529-es azonosítójú, több tucat mutációval rendelkező koronavírus variánst, amit omikronnak neveztek el, és elsőként Botswanában és a Dél-afrikai Köztársaságban észleltek.
Jelenleg nagyon kevés biztosat tudni az omikron más variánsokhoz viszonyított terjedési képességéről és az általa okozott betegség súlyosságáról. Bár a legtöbb várakozás szerint az oltások az omikron esetén is védelmet nyújtanak majd a súlyos megbetegedés ellen, az enyhe megbetegedéssel és fertőződéssel szembeni hatásosságuk csökkenhet. Ennek ellenére a legjobb védekezés az omikron ellen továbbra is az oltás, illetve a védettség harmadik oltással való megerősítése.
Az omikron az eddig feltárt genomok változatosságának tanulmányozása alapján Kristian Andersen fertőző betegségek genetikai vizsgálatával foglalkozó kutató szerint október óta terjedhet emberek között. Arról, hogy a variáns honnan jöhetett, Andersen szerint jelenleg két lehetségesnek tűnő elmélet létezik. Az egyik az, hogy a variáns egy vagy több immunhiányos betegben, krónikus koronavírus-fertőzés során alakult ki, és ezt az elméletet támogatja a University College London Genetikai Intézetének fertőző betegségek genetikai kutatásával foglalkozó vezetője, Francois Balloux is.
Andersen azonban egy másik, spekulatívabb lehetőséget is felvet, mégpedig azt, hogy az omikron egy újabb zoonózis eredménye, azaz hogy az új variáns emberekről egy ismeretlen állatfajra került, és onnan jutott vissza az emberi populációba. A vírusok evolúciójával foglalkozó amerikai professzor, Jesse Bloom szerint nagyon korai még komolyabb következtetéseket levonni arra nézve, hogy miként szedte össze a variáns a mutációit, de több közülük erősen összefügg az emberi antitestes immunválasz kikerülésével, ezért úgy véli, az immunszelekció az egyik faktor, ami hozzájárult az omikron kialakulásához.
Az omikron variáns genomja közel 50 genetikai változással rendelkezik a koronavírus eredeti, vuhani variánsához képest. Ezek legnagyobb része, 32, a vírus S-fehérjéjén található aminosavakat módosítja. A koronavírus fehérjéit, pontosabban azok aminosavsorrendjét a vírus RNS genomja kódolja. A vírus RNS-ének a sejtben való, a vírus úgynevezett RNS-dependens RNS polimeráz enzimje általi másolása során bekövetkező hibák mutációkhoz vezethetnek, amelyek módosítják az RNS által kódolt aminosavakat, esetlegesen befolyásolva a fehérjék szerkezetét vagy működését. A legtöbb mutáció neutrális, azaz nem módosít a vírus viselkedésén, de ritkábban előfordulhat az is, hogy néhány változás szelekciós előnyhöz juttatja a kórokozót.
A tüskefehérjék a koronavírusok felszínén elhelyezkedő nagy strukturális fehérjék, amelyek a vírus sejtbe jutásáért felelnek, így elengedhetetlenek a vírus replikációjához. A SARS-CoV-2 S-fehérjéje, hasonlóan az eredeti SARS vírushoz, az emberi ACE2 sejtfelszíni receptorral áll kölcsönhatásban. Az S-fehérje 1273 aminosavból áll, és több funkcionális egységgel rendelkezik. A kulcsfontosságú receptorkötő hely (RBD, receptor binding domain) az S1 régióban található, és ez kötődik közvetlenül az emberi ACE2 receptorhoz.
Az mRNS- (Pfizer, Moderna) és az adenovírusvektor-alapú oltások (AstraZeneca, Szputnyik, Janssen) is az S-fehérje kódját juttatják be sejtjeinkbe, amelyek legyártják a koronavírus ártalmatlan S-fehérjéjét, hogy az immunrendszerünk fel tudja ismerni őket, és antitesteket tudjon termelni ellenük. Korábbi cikkünkben részletesen írtunk arról, hogy az oltások által termeltetett poliklonális antitestek, illetve a sejtes immunitás kicselezése miért nem egyszerű a vírusnak, akkor sem, ha az S-fehérje szerkezete mutációknak köszönhetően megváltozik.

Az omikron tüskefehérjéjén található 32 változásból 28 mutáció, azaz egyszerű aminosavcsere eredménye. Három közülük deléció, azaz egy vagy több aminosav kiválása a fehérje szerkezetéből, egy pedig úgynevezett inszerció, azaz egy vagy több aminosav beépülése a fehérje szerkezetébe. Mind a négynél kis méretű szakaszokról van szó. Összességében a 32 változásból 15 érinti a fehérje receptorkötő helyét. A mutációk közül sok előfordult már korábbi, aggasztó variánsoknál, így a bétánál vagy a deltánál, néhány azonban teljesen egyedi. Fontos lehet az is, hogy az Igem genomikai intézet professzora, Sergei Pond bioinformatikus által végzett kezdeti vizsgálat szerint az omikron S-fehérjéje erős szelekciós nyomást mutat, amely arra utalhat, hogy bizonyos mutációk evolúciós előnyt biztosíthatnak a vírusnak (az, hogy pontosan mire optimalizál ezzel a vírus, még nem tisztázott).
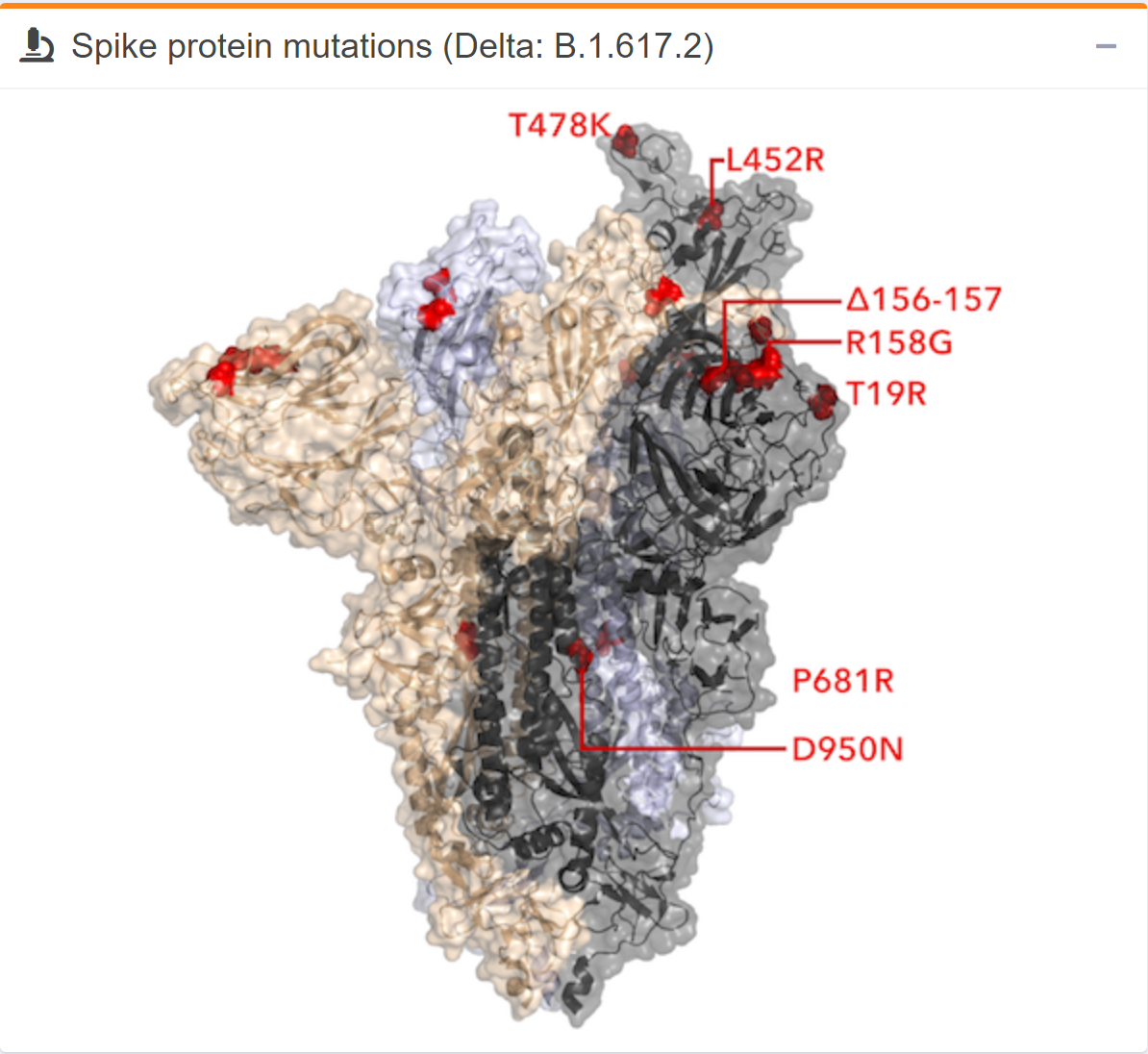
Mit tudunk az S-fehérje változásairól?
Érdemes néhány, az omikronra jellemző mutációt és változást megvizsgálni, mert ezek egyéni, specifikus szerepéről korábbi kutatások alapján vannak már információink. Egy 2021 februári, a Nature-ben közölt tanulmány alapján tudjuk, hogy az alfa variánsban is jelen lévő ΔH69/ΔV70 deléció kétszer nagyobb fertőzőképességgel járhat együtt az eredeti vírusváltozathoz képest. A beta variánsban szintén megtalálható N501Y mutáció az eLife biológiai szakfolyóiratban augusztusban közölt tanulmány alapján erősebb interakcióhoz vezet az S-fehérje receptorkötő régiója és az ACE2 receptor közt, ezáltal növeli a koronavírus terjedési képességét.
Ugyanerre jutott egy pár nappal később az eLife-ban közölt tanulmány is, amely szerint az S477N mutációnak hasonló szerepe lehet, mint az N501Y-nak, míg a K417N az immunválasz hatékonyabb kikerülését segítheti. Az E484 helyen történő változás egyszerre javíthatja az ACE2-höz való kötődést és az antitestek kikerülését. Egy a Science-ben júniusban közölt kutatás alapján úgy tűnik, a K417, E484 (ez a kettő a beta variánsnál is előfordul), illetve G446 helyeken bekövetkező mutációk együttes hatása az antitest-neutralizáció részleges kikerülése lehet. A deltánál is megtalálható L452R mutáció az S-fehérje stabilitását és így a vírus fertőzőképességét javíthatja.
Az alfa variánsra is jellemző P681H egy, a bioRxiv preprint szerverre feltöltött vizsgálat szerint a sejtek antivirális aktivitásában résztvevő I-es típusú interferon válasszal szembeni ellenállást biztosíthat. A delta variánsnál is előforduló P681R egy néhány napja a Nature-ben közölt kutatás szerint nagyobb patogenitást adhat a vírusnak az S-fehérje hatékonyabb vágásán keresztül. További két, a deltánál is megjelenő mutációnak, a T478K-nak és a D614G-nek a hatása az S-fehérje és az ACE2 receptor közötti kötést erősítheti, így növelhetik a vírus fertőzőképességét.
Az omikron a vírusgenom más régióiban is hordoz változásokat, amelyek összesen 18 aminosav-mutációt eredményeznek más, a tüskén kívül fehérjéken. Négy változás ezek közül az immunválasz tompításában szerepet játszó NSP3 fehérjén található, további hat pedig más nem strukturális fehérjéken (NSP4, NSP6, NSP12 és NSP14). Egy mutáció van a burokfehérjén, három a vírus felépítésében fontos szerepet játszó membránfehérjén, és végül négy változás a vírus RNS genomját becsomagoló nukleokapszid fehérjén.
Mi lesz a mutációk együttes hatása?
A brit egészségügyi biztonsági hivatal (UKHSA) kutatói szerint korábbi vizsgálatok alapján az omikronon lévő változások az immunitás kikerülésében, a terjedés hatékonyságában és a vírus egyes kezelésekkel szembeni ellenállóképességében jelentkezhetnek (ilyen a monoklonális antitest-terápia). Az episztázisnak nevezett genetikai jelenség miatt azonban nem tudhatjuk biztosan, hogy mi az omikron által hordozott mutációk együttes hatása.
A New York Times által megszólaltatott Jesse Bloom szerint a mutációk elméletileg egymás ellen is hathatnak, ugyanakkor ebben az esetben valószínűbb, hogy az evolúciós szelekciós nyomás olyan új variáns terjedéséhez vezet, amely a vírusnak kedvező mutációkkal rendelkezik. Bloom szerint nem tudjuk, hogy milyen lesz a mutációk együttes hatása, ezért nem is tudjuk előre jelezni a mutációk alapján, hogyan viselkedik majd a vírus az emberi szervezetben.
Bár valószínű, hogy az oltások az omikron variáns esetén is megőrzik hatásosságukat a súlyos megbetegedéssel szemben, a konkrét, a vakcinák hatásosságára vonatkozó kísérleti eredményekre valószínűleg még heteket kell várni. A Pfizer oltását kifejlesztő BioNTech vezérigazgatója, Ugur Sahin a Reutersnek elmondta: valószínű, hogy az oltottaknak továbbra is jelentős védettségük lesz az omikron által okozott súlyos megbetegedés ellen. Sahinnak arra számít, hogy a laboratóriumi tesztek valamekkora csökkenést mérnek majd az enyhe és középsúlyos megbetegedéssel szembeni védelemben, de a csökkenés mértékét nehezen lehet előre jelezni. Ezeknek a laboratóriumi teszteknek az eredménye a Reuters szerint a következő két hétben várható.
Hasonlóan vélekedik az Oxfordi Egyetem, amely részt vett az AstraZeneca oltás kifejlesztésében. November 30-i nyilatkozatuk alapján arra számítanak, hogy „az új variánsok megjelenése ellenére az oltások továbbra is nagyon magas védelmet biztosítottak súlyos megbetegedés ellen, és nincs arra bizonyíték, hogy az omikron esetén ez másképp lenne". A Moderna vezérigazgatója úgy véli, hogy az oltás megbetegedés elleni hatásossága alacsonyabb lesz, mint a delta variáns esetén, de egyelőre nem lehet tudni, mekkora lesz a csökkenés. A Pfizer-BioNTech és a Moderna által alkalmazott mRNS technológia egyik előnye, hogy az oltások szükség esetén nagyon gyorsan megváltoztathatók, és viszonylag könnyedén készíthetők variánsspecifikus dózisok. Ilyen, a a koronavírus korábbi variánsai ellen bevethető specifikus dózisokkal a BioNTech a Moderna is rendelkezik, sőt a Modernának a korábbi variánsok kombinációi ellen is van megoldása.
Jó hír az is, hogy Balloux szerint a koronavírus elleni antivirális gyógyszerek, az MSD-Ridgeback Therapeutics Molnupiravirjának és a Pfizer Paxlovidjának működési mechanizmusa miatt valószínűtlen, hogy az omikron befolyásolná hatásosságukat, és ezen a véleményen van az MSD is.
Kapcsolódó cikkek a Qubiten:

Megjelent az új mutáns, az omikron, de a lehető legjobb védekezés továbbra is az oltás
A bizonyítékok továbbra is arra utalnak, hogy a magasabb átoltottságú országokban hamarabb lesz vége a járványnak. Az előrejelzések szerint ugyanakkor a koronavírus hosszú távon is velünk marad, és a többi 200 légúti vírushoz hasonlóan endemikussá válik.
Több országban is kisebb pánikot keltett a koronavírus újonnan megjelent variánsa, a B.1.1.529
A koronavírus új, mutáns variánsát először Botswanában azonosították, de jelentettek már fertőzöttet a Dél-afrikai Köztársaságból, Hongkongból és Izraelből is. Pénteken összeült a WHO, hogy megvizsgálja, „aggodalomra okot adó" variánsról van-e szó. A B.1.1.529 várhatóan a nű nevet kapja majd.

Mi haszna a koronavírus elleni oltásnak, ha úgyis elhalványul az immunitás?
A jelenleg uralkodó SARS-CoV-2 vírusvariáns, a delta fertőzőbb, mint az eddigiek, és gyorsabban okozhat súlyosabb tüneteket. Egyre kevésbé látszik, mikor érhet véget a járványhelyzet. Adódik a kérdés: vajon mennyire hatékonyak és mitől védenek meg a vakcinák?
Kapcsolódó cikkek