Egy lépéssel közelebb jutottunk az élet eredetének megértéséhez

Az első fehérjék különleges RNS-molekulákon jöhettek létre közel 4 milliárd éve – derül ki egy új kutatásból, ami fontos előrelépést jelent az élet kialakulásának megértéséhez.
A szakemberek többsége szerint az élet hajnalán az RNS egyszerre volt képes örökítőanyagként viselkedni és kémiai reakciókat lebonyolítani. Csak ezután alakult ki a földi élet alapjául szolgáló molekuláris feladatmegosztás, amelyben a nukleinsavak, mint a DNS (dezoxiribonukleinsav) és az RNS (ribonukleinsav) alapvetően információt tárolnak, míg az általuk kódolt fehérjék elsősorban reakciókat katalizálnak.
Ma minden ismert sejtes létformánál két alapvető folyamat kell a fehérjék létrejöttéhez, és ezek eredete legalább az összes földi élőlény utolsó közös őséig (Last Universal Common Ancestor, LUCA) nyúlik vissza. Elsőként a DNS által kódolt genetikai információ RNS-sé való átírása történik meg – ez az úgynevezett transzkripció. Ezután megy végbe a létrejött hírvivő RNS (mRNS) nagy, RNS-ekből és fehérjékből álló molekuláris gépezetek, riboszómák segítségével történő lefordítása a fehérjéket felépítő aminosavláncokká – ezt nevezik transzlációnak.
A múlt héten a Nature-ben Felix Müller, a müncheni Ludwig-Maximilians Egyetem kémikusa és kollégái által közölt eredmények ezt az RNS-világból a jelenlegi élet felé vezető kritikus átmenetet világítják meg. Mindezt olyan kísérletek segítségével teszik, amelyekben RNS-molekulákon egyszerű fehérjéket állítottak elő. Ezekhez a szokásostól kissé eltérő építőkövekből létrejövő RNS-eket használtak, amelyek most is számos életfolyamat részei, és a földi élet keletkezésénél is jelen lehettek.
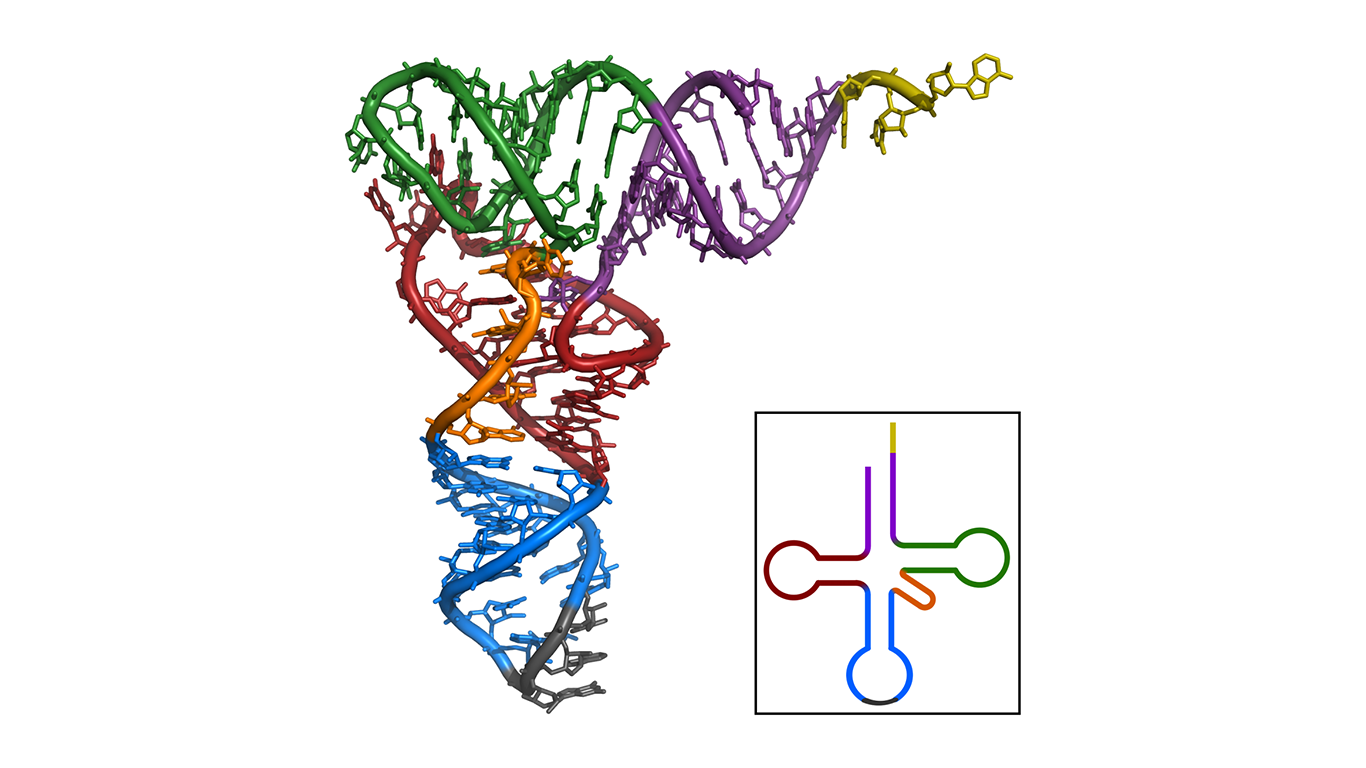
Bár a DNS és az RNS általában négy szokványos alegységből vagy nukleotidból épül fel, melyek adenin, guanin, citozin, illetve a DNS-nél timin, az RNS-nél pedig uracil bázisokat tartalmaznak. De vannak ezeknek kémiailag kissé módosult, sejtjeinkben gyakran előforduló verziói, amelyek a fehérjeszintézishez kulcsfontosságú transzfer RNS-ben (tRNS) és riboszómális RNS-ben vannak jelen, és a kutatók szerint az RNS-világ molekuláris maradványai lehetnek.
A Müller és kollégái által ilyen speciális alegységeket tartalmazó RNS-ekkel több lépésben végrehajtott kísérletek során komplex, fehérjékkel díszített „kiméra RNS- molekulák” jöttek létre. A kísérleteket olyan, változóan nedvesebb és szárazabb körülmények között végezték, amelyek jellemzőek lehettek az ősi Földön, illetve a Marson is. Amikor úgynevezett 2'-OMe nukleotidokkal stabilizálták az RNS-molekulákat, elég hatékonyan sikerült 9 aminosavból álló peptideket előállítaniuk, bizonyítva, hogy a peptidek képesek RNS-eken aminosavak egymásra épülésével növekedni. Emellett azt találták, hogy kísérleti rendszerük preferáltan bizonyos típusú peptideket hoz létre, illetve egy RNS-en egyszerre több peptid is keletkezhet.

Claudia Bonfio, az eredményeket a Nature-ben kommentáló biokémikus szerint a kutatás fontos korlátja, hogy Müllerék kémiai rendszere nem képes RNS-szekvenciák leolvasására és azok által kódolt peptidek gyártására, ahogy az a mai fehérjeszintézis során történik. A kutató azonban ennek ellenére úgy látja, hogy a mechanizmus ilyen szempontból is ígéretes, mivel létrejötte megnyithatta az RNS-dekódolás kialakulásához szükséges evolúciós utat.
Müller és munkatársai szerint a kezdetleges fehérjeszintézis hatékonysága kémiai evolúcióval javítható, és mivel a létrejött molekulák viszonylag stabilak, a folyamat idővel komplexebb RNS-peptid-struktúráknak ágyazhat meg. Ez szerintük egy szimplán RNS-világ helyett inkább egy ősi RNS-fehérje-világ létére utalhat, amelyből lépésről lépésre kialakulhatott a mai, riboszómákra támaszkodó fehérjeszintézis. Úgy vélik, ez felveti annak lehetőségét, hogy a kémiai kötésekkel összekapcsolt RNS-ek és peptidek az élet kezdetén közös evolúción estek át, és a következő több milliárd évre megalapozták a nukleinsavakon és fehérjéken alapuló földi életet.
Kapcsolódó cikkek a Qubiten:

Ha az élet keletkezéséről van szó, a legkreatívabb fantázia sem tud versenyre kelni több százmillió év kémiai kísérleteivel
Az evolúciós átmenetek néven ismertté vált elméletet továbbfejlesztő budapesti iskola tagjai az elmúlt három évtized hazai eredményeit foglalták össze a Nature Reviews Chemistry-ben megjelent cikkükben. A tanulmány társszerzőjét, Szilágyi András biofizikust kérdeztük az élet eredetét firtató kutatásokról.

Videóajánló: A brit kémikus, akinek elmélete segíthet az élet eredetének megfejtésében
Lee Cronin, a Glasgow-i Egyetem professzora szerint az élet eredetének megértéséhez nem a múltban kell kutatkodni, hanem ki kell találni, hogyan tudjuk az életet azonosítani. Mivel az élet alapja az evolúció, ezért már csak az a kérdés, hogyan tudjuk megmondani egy molekuláról vagy objektumról, hogy azt evolúció hozta létre.

Már a Föld születésétől kezdve érkeztek bolygónkra az élethez nélkülözhetetlen anyagok a külső Naprendszerből
Kutatók a földköpeny mélyéről származó mintákban lévő kriptont vizsgálták, amely fényt derített bolygónk formálódásának körülményeire. Kiderült, hogy az élethez szükséges anyagokat részben a külső Naprendszerből származó por és jeges bolygókezdemények juttathatták a Földre.
