Öregedésünkről és élettörténetünkről mesélnek a magyar kutató vezetésével létrehozott sejtfagyűrűk

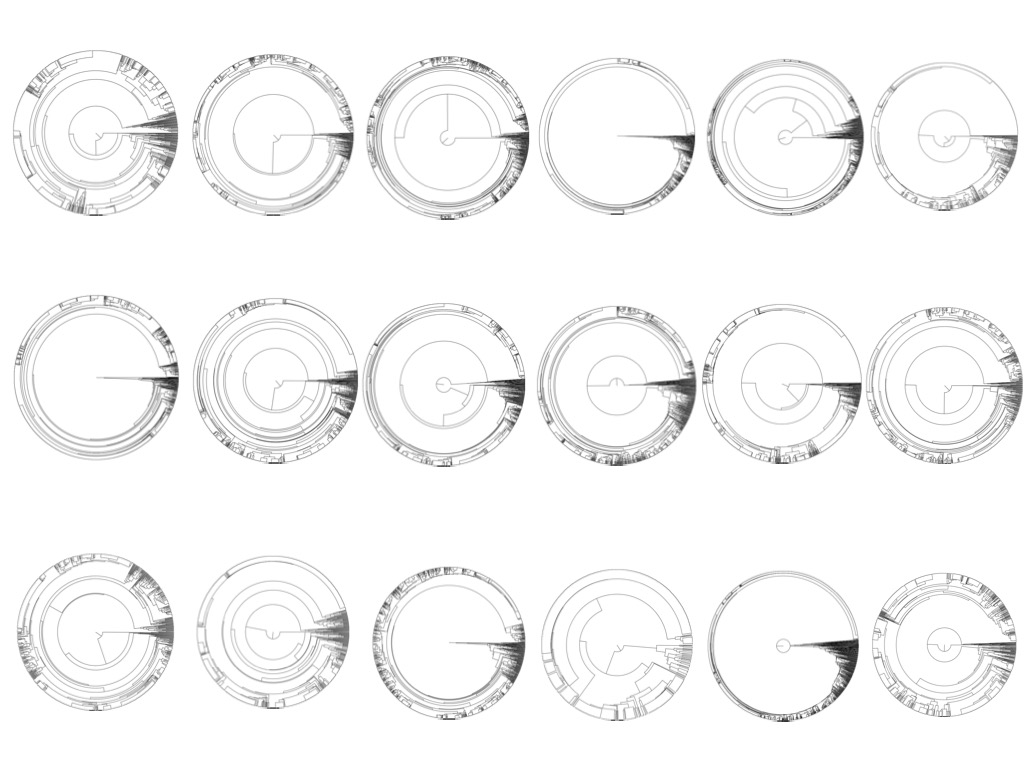
Olyan innovatív, a biológiai öregedést mérő órát készítettek kutatók egy magyar szakember vezetésével, ami reményeik szerint segíthet az egészséges élettartamot meghosszabbító terápiák fejlesztésében és tesztelésében. A „sejtfagyűrűk” koncepcióját követő öregedési óra az élővilág evolúciós kapcsolatait tükröző törzsfákhoz hasonlóan ábrázolja sejtjeink élettörténetét a bennük az évek során felhalmozódó mutációk alapján.
Csordás Attila, az AgeCurve biotechnológiai startup vezetője és kollégái a GeroScience folyóiratban publikálták tanulmányukat január elején. A kutatás során 18 önkéntestől vettek vérmintát, és az ezekben található több ezer sejt szekvenálásából sejtfákat hoztak létre. Az a biológiai életkor, amit ezekből a sejtfákból számoltak ki, jó egyezést mutatott a kronológiai életkorral, és annál jobban előre is tudta jelezni több klinikailag fontos, a vérből kimutatható biomarker szintjét.
„A biológiában mindennek csak az evolúció fényében van értelme” – idézte fel Csordás a Qubitnek Theodosius Dobzhansky orosz-amerikai evolúcióbiológus híres mondását. Ezt ő az orvostudományra vonatkozóan úgy alakítaná át, hogy „semminek nincs értelme az orvostudományban, csak a biológiai öregedés fényében”. A szakember, aki korábban 9 évig dolgozott bioinformatikusként az Európai Bioinformatikai Intézetben (EBI), azt szeretné bebizonyítani, hogy a biológiai öregedésben a sejtfák és az egyén testi sejtjeinek evolúciós története a legfontosabb.
Csordás szerint soha korábban nem építettek egészséges embereknél ennyi sejtből hasonló sejtfákat – ezt most a finomhangolt módszerek mellett a génekről átíródó RNS megszekvenálása, majd a DNS mutációinak ebből történő visszafejtése tette nekik lehetővé. Az elmúlt években egyre nagyobb érdeklődés mutatkozik az egészséges élettartam kitolása (longevity) iránt, és a Nature Methods szakmai folyóirat nemrég megjelent cikke szerint mára kezdi komoly területté kiérni magát az öregedéskutatás. Ennek ellenére a kutatási ágra továbbra is jellemzők az eltúlzott ígéretek, és vezető kutatók munkáját is komoly kritikák érik.
„Ez egy módszertanilag impresszív vizsgálat érdekes felvetéssel, ami végül nem egyértelmű, hogy előrelépés-e a szomatikus evolúciós folyamatok megértésében” – kommentálta a Qubitnek a kutatást Szöllősi Gergely az ELTE TTK Biológiai Fizika Tanszékének és a HUN-REN Evolúciótudományi Intézetének munkatársa. Az evolúcióbiológus, aki az élővilág több száz millió évet felölelő evolúciójának megértését célzó kutatások mellett a daganatos megbetegedésekhez vezető evolúciós folyamatokkal is foglalkozik, azt állítja: Csordásék munkája egy érdekes koncepciót mutat be, de erősen fenomenológiai, vagyis szubjektív megközelítésre alapoz.
Szöllősi rámutatott, hogy vitatható az „öregedési órának” az a feltételezése, hogy az öregedés komplex, soktényezős folyamata egyetlen számra, „a biológiai korra” redukálható, és a tanulmány olvasása után is szkeptikus maradt ennek helyességét illetően. „Mindazonáltal a vizsgálat lenyűgöző új adatokat ismertet és analizál a perifériás vér egysejtes RNS-szekvenálásából” – tette hozzá. A szakember szerint nagyon ígéretes a tanulmány absztraktjában szereplő állítás, miszerint a sejtek leszármazási fáinak egyedi, szekvenciaadatokból rekonstruált alakja rögzíti a szomatikus evolúciót, illetve feltárhatja az öregedési folyamat időbeli történetét, de ezt aligha támasztja alá 21 klinikai vérmarker, valamint a kronológiai életkor és a „sejtfa-életkor” közötti összefüggés vizsgálata, ahogy az a cikkben szerepel.
Az öregedés önmagában nem betegség
Az egész longevity (vagyis az egészséges élettartam meghosszabbítását célzó) iparág 2013 körül indult, amikor a Google anyavállalata, az Alphabet milliárdos szintű befektetést tett a Calico nevű, öregedéssel foglalkozó startupba. Csordás szerint ugyancsak ekkoriban jelent meg a rangos Cell folyóiratban egy áttekintő tanulmány, amiben az öregedés kilenc biológiai jellegzetességét fektetik le. Ezek közül a szakember a genomi instabilitást, a nem az örökítőanyag bázissorendje által kódolt epigenetikus változásokat, a kromoszómák telomereinek rövidülését, a mitokondriumnak nevezett energiatermelő sejtszervecskék működési zavarait, őssejtek kimerülését és a sejtek közötti kommunikáció megváltozásából adódó immunológiai folyamatokat emelte ki.
Azt, hogy a testi sejtekben (szomatikus sejtek) felhalmozódó mutációk felelhetnek az öregedésért, 1952-ben vetette fel először a brazil-brit biológus, Peter Medawar. Hipotézisének értelmében a káros mutációk hatása csak idősebb korban érvényesül, amikor a szaporodás már befejeződött, így az öregedéshez vezető mutációk ellen alig tud fellépni a természetes szelekció. Néhány évvel később, 1959-ben Szilárd Leó publikálta matematikai modelljét az öregedésről, amiben a szomatikus mutációk felhalmozódásának hatásait vizsgálta. Ma már tudjuk, hogy az ivarsejtek jobban védettek a mutációkkal szemben, mint a testi sejtjeink, amelyekben lényegesen gyakoribb a kialakulásuk. Csordás szerint a daganatos megbetegedések létrejöttének megmagyarázására kiválónak bizonyult a mutációs hipotézis, de az öregedés nem csak erre vezethető vissza – ugyanakkor a segítségükkel szomatikus mutációkon alapuló öregedési óra készíthető.
Míg a testi sejtekben felhalmozódó mutációk visszafordíthatatlanok, az egy szinttel feljebb végbemenő epigenetikai változások visszafordíthatónak tűnnek úgynevezett Jamanaka-faktorok segítségével. Arra, hogy epigenetikai változások mérésével öregedési órák hozhatók létre, 2011 körül jött rá a magyar származású öregedéskutató és genetikus, Steve Horvath. Csordás azt állítja, hogy az elmúlt években létrehozott, epigenetikai alapú öregedési órákkal általában komoly megbízhatósági és robosztussági problémák voltak, de ennek ellenére jelentős hatásuk van a fejlődésbiológiai kutatásokban, és megbetegedések hatásainak vizsgálatára is alkalmazzák őket. Ahogy az is előfordult már, hogy mormoták öregedését vizsgálták vele, és arra az eredményre jutottak, hogy az állatok a téli hibernációjuk alatt lassabban öregszenek.
Akár szomatikus mutációkon, akár epigenetikai változásokon alapul, egy jó öregedési óra által megadott biológiai életkornak első lépésben jelentős egyezést kell mutatnia a kronológiai életkorral. Csordás szerint a kronológiai életkor a legnagyobb kockázati tényezője a legtöbb súlyos megbetegedésnek, ugyanakkor az öregedés önmagában nem betegség, hiszen a bizonyos kort megélt emberi populáció 100 százalékát érinti. A szakember szerint most az a nagy kérdés az öregedéskutatásban, hogy az amerikai Élelmiszer- és Gyógyszerügyi Hivatal (FDA) engedélyezhet-e kizárólag kronológiai életkor alapján gyógyszereket. Arra viszont nincs idő, hogy évtizedes klinikai vizsgálatokat futtassunk egy-egy, az egészséges élettartamot növelő terápia tesztelésére, így a biológiai óráknak ezek tesztelésében lehet igazán fontos szerepük.
Egy sor problémával járhat a vérképző őssejtek öregedése
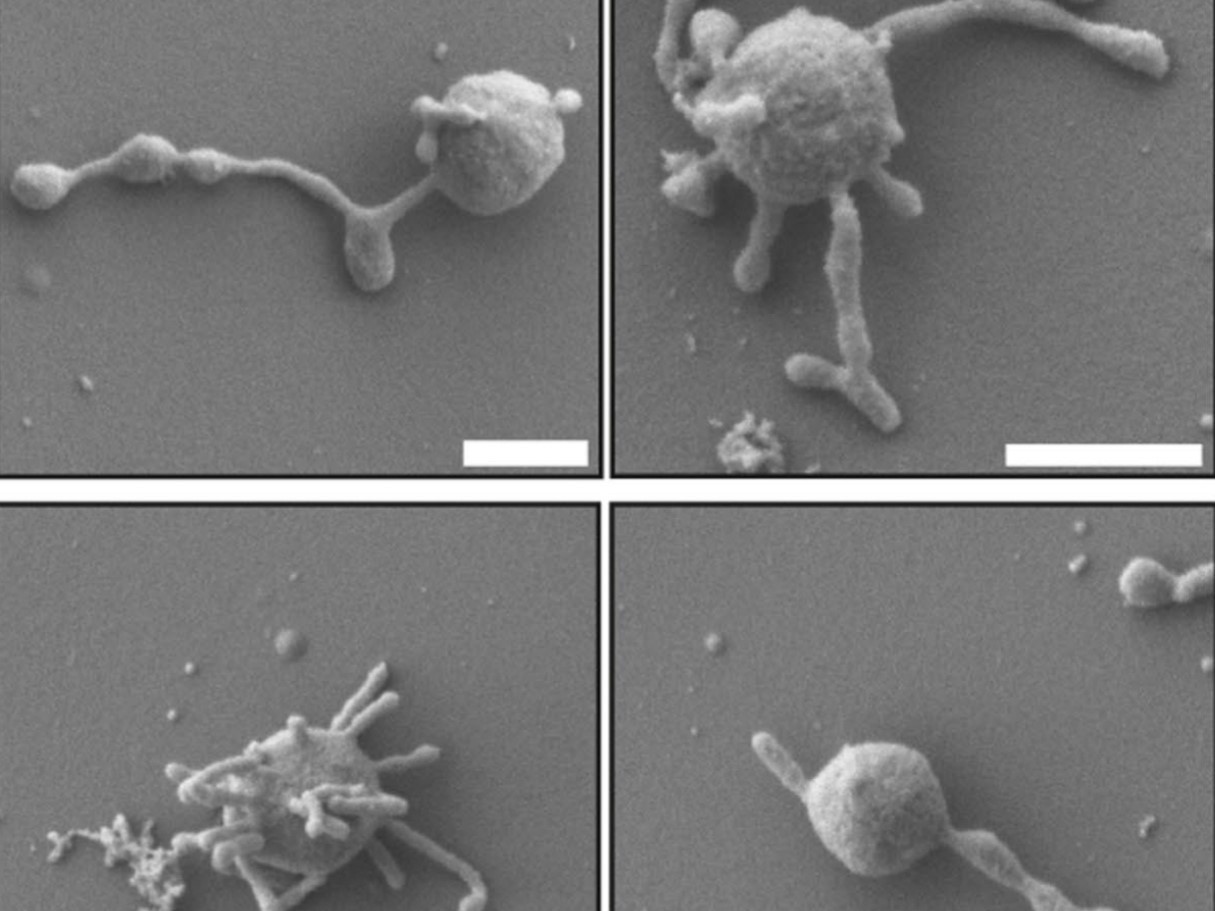
Csordás és kollégái a prágai Healthy Longevity Klinikával együttműködésben 18 önkéntestől vettek vérmintát; a tíz férfi és nyolc nő életkora 21 és 82 év között mozgott. A kutatók a vérmintákból perifériás mononukleáris sejteket izoláltak, köztük immunsejteket, például a vírusos fertőzések legyőzésében kulcsszerepet játszó B- és T-sejteket. Ezek a sejtek vérképző (hemopoetikus) őssejtekből alakulnak ki, amikre az öregedés jelentős hatást gyakorol.
A CHIP néven ismert jelenség a szomatikus evolúció része, melynek során ezek az őssejtek genetikailag elkülönülő vérsejt-populációkat hoznak létre – úgynevezett koloniális expanziókat, amik egyes vizsgálatok szerint a 70 év felettiek 10-20 százalékára jellemzők. Ezek az alpopulációk genomjaikban közös mutációkkal rendelkeznek, amit egyetlen sejttől örököltek és genetikailag annak klónjainak tekinthetők. A kutató szerint részben ez okozhatja, hogy az immunrendszer idősebb korban már nem annyira rugalmas, hiszen az adaptív immunsejtek jelentős része csupán néhány, évtizedekkel korábban mutálódott sejt klónja. Ennek jelentőségét egy múlt héten közölt kutatással világította meg, amely azt találta, hogy a 67-90 év közötti vizsgálati alanyoknál a „klonális vérképzésként” ismert biomarker megnövekedett szív- és érrendszeri halálozással, leukémiával járó halálozással és általános halálozással mutat szignifikáns összefüggést.
Mint Csordás elmondta, a vérképző őssejtek génjeiben akár évente 14-20 bázis is kicserélődhet, és ezeknek a – néha daganatok kialakulásához vezető – szomatikus mutációknak a felhalmozódása történhet lineáris vagy exponenciális ütemben is. A sejtpopulációban így az évek során kialakuló mutációs teher a sejtek megszekvenálásával és a szekvenciák evolúciós rokonságának vizsgálatával (filogenetika) egy sejtfa felállítását is lehetővé teszi. A sejtfa mint fogalom, mesélte Csordás, Cambridge-ben végzett kutatásokra vezethető vissza, amelyekben a későbbi Nobel-díjas John Sulston és kollégái az azóta genetikai kutatásokban modellorganizmusként használt Caenorhabditis elegans fonálférget vizsgálták.
Sulston és kollégái éjszakába nyúlóan figyelték, ahogy a zigótából kialakulnak az áttetsző állat sejtjei, hogy az összes sejtosztódást fel tudják térképezni. Csordás szerint ez hasonlóképpen működik az embernél is, hiszen mind a közel 37 billió sejtünk egy zigótából alakul ki. Ha ezekből a sejtekből kivesznek genetikai karaktereket, és a fán egy evolúciósan összekötött sejtpopulációból sejteket ábrázolnak, akkor ugyanazokkal az evolúciós algoritmusokkal, amikkel fajok törzsfáját szokták rekonstruálni, egy sejtfát is fel lehet állítani.
Az ötlet, hogy egysejtes szekvenálással kimérhetők a mutációk, és azokat egyfajta vonalkódként felhasználva felállítható a sejtpopuláció sejtfája, 2008 körül született meg Csordás fejében, amikor a New Orleans-i Tulane Egyetemen dolgozott őssejtbiológusként. A kutató eredeti gondolata az volt, hogy az összes emberi sejt egy fa lombkoronáján található leveleknek felel meg, a fa alakja és elágazásai pedig a sejtpopuláció és az egyed élettörténetéről mesélnek, ez pedig egyfajta prediktív matematikai elmélet kidolgozását teszi lehetővé.
Szöllősi szerint az utóbbi néhány évben nagyon sokat megtudtunk a vérképző rendszerben zajló szomatikus evolúcióról, többek között Emily Mitchell és kollégáinak 2022-es Nature-tanulmányának köszönhetően. Ebben a kutatásban 3579 genomot szekvenáltak meg, és azt találták, hogy a vérképző őssejtek jó ideig többnyire egyenletes, „óraszerű” evolúciót mutatnak, ám 75 év felett jelentősen lecsökken a sejtek klonális változatossága, és néhány őssejt utódai kezdenek dominálni, amelyekben a szervezetnek káros, de utódaik számosságát tekintve pozitív mutációk jelennek meg. Ezekkel az eredményekkel konzisztens Csordásék fő hipotézise, miszerint a sejtek leszármazási fáinak alakja alkalmas az öregedés mérésére, de Mitchellékkel ellentétben nem prezentálnak konkrét evolúciós mechanizmust ennek magyarázatára.
Egysejtes RNS-szekvenálással értek el áttörést
A kutatók a vérmintákból izolált sejteket egy új generációs szekvenálási (NGS) technológiának, úgynevezett egysejtes RNS-szekvenálásnak (single cell RNAseq) vetették alá. Ezzel a kutatók vissza tudták fejteni, hogy a sejtek genomi DNS-ében a fehérje kódoló gének milyen mutációkat halmoztak fel az évek során. Korábban úgy tűnt, hogy a módszerrel a genom 2 százalékából összeszedhető mutációk száma nem lesz elegendő sejtfák építéséhez, de Csordás szerint erre sikerült rácáfolniuk.
„Képesek voltunk arra, hogy csak a fehérjekódoló régiókból elegendő mutációt vegyünk ki, hogy eléggé elágazó fákat építsünk” – mondta. Ehhez a laboratóriumi protokoll módosítására és egy megfelelő bioinformatikai elemzés lefuttatására volt szükség. Csordás szerint az egysejtes RNS-szekvenálás azért áttörő a sejtek teljes genomi DNS-ének meghatározásával szemben, mert annál lényegesen olcsóbb, és a jövőben még nagyobb vizsgálatoknak ágyazhat meg. Miután a szekvenciaadatokból létrehozták a filogenetikai fákat, azt vizsgálták, hogy matematikailag miként jellemezhetik azok alakját. Ebben a kutató által társfelfedezőjének nevezett Damien Hicks fizikusnak és a filogenetikus Sipos Botondnak jutott fontos szerep, akikkel együtt ezeket a metrikákat kidolgozták. Hicks többek közt a digitális jelfeldolgozásból jól ismert Fourier- es wavelet-transzformáció módszerét adaptálta a sejtfák alakjának reprezentálására.

A 18 önkéntes sejtfájának létrehozása után a kutatók megvizsgálták, hogy a szomatikus mutáció alapú biológiai órájuk által adott életkor mennyire esik egybe az adott személy kronológiai életkorával. A kettő között erős korrelációt találtak, de az is igaz, hogy még mindig kevésbé precíz ez az óra egyes epigenetikai órákhoz képest. Csordás szerint azonban a túlzott életkori korrelációnak hátulütői is vannak, mivel így nehezebb feltárni a kronológiai és biológiai életkor közötti speciális eltéréseket egyes embereknél, valamint azoknak az okait, ami az öregedéskutatás egy másik fontos célja.
A szakemberek 13 főnél különböző vérmarkereket (például a vércukor vagy a szérumalbumin szintjét) vizsgáltak, és azt találták, hogy a sejtfa által megadott életkor jobban képes előre jelezni a szintjüket, mint a kronológiai életkor. A 18 önkéntes sejtfájából összeálló modellt a kutatók még 18 másik, a Human Cell Atlasból származó publikus mintán is validálták, és a tanulmány elkészítése óta jelentősen növelték a vizsgált minták számát. Csordás azt állítja, hogy a növekvő mintaszám mellett a modell továbbra is működik.
A végső cél a gyógyszerfejlesztés
Csordásék célja, hogy idővel az egész élettörténetünk és az egészségünket befolyásoló lényeges események felvázolhatók legyenek egy sejtfán, ami az élőlények közötti evolúciós kapcsolatot feltáró „élet fájához” hasonlóan az egyén „élet- és halálfája” lenne. Bár most csak 2000 sejtet vizsgáltak, a kutató szerint az egysejtes RNS-szekvenálási módszerük megnyitotta az utat abba az irányba, hogy ezt a jövőben akár egymillió sejtre is fel lehet skálázni, amivel már egy, az egész emberi szervezetre reprezentatív sejtfát lehetne készíteni. Az ugyanakkor továbbra is kérdés, hogy az egyre nagyobb fákból mennyi új információt lehet kinyerni.
Mindezek előtt azonban még fel szeretnék használni a mintákból megmaradt, a génekről átíródott mRNS mennyiségét megadó transzkriptom-szintek adatait. Ezekből Csordás szerint transzkripciós öregedési órákat lehet építeni, amiket aztán kombinálni lehet a szomatikus mutációk alapján készült öregedési órával. Továbbá nem lineáris modelleket alkalmazó öregedési órákkal is szeretnének próbálkozni, mivel az öregedésben nyilvánvalóan vannak nem lineáris folyamatok is – ezek fontosságát jól mutatja, hogy például a covidhoz hasonló vírusos fertőzések esetén az életkori kockázat exponenciálisan növekedhet.
A kutatót elsősorban az foglalkoztatja, hogy miként lehetne a szomatikus mutációk felderítésén, egészségügyi kockázataik megértésén, valamint a sejtfán keresztül új diagnosztikai eljárásokat és gyógyszeres terápiákat kifejleszteni. Csordás szerint a szomatikus mutációkon alapuló öregedési órájuk a jövőben pontosabban jelezheti előre az egyén egészségügyi állapotát és halálozási kockázatát is, mint az életkor alapú predikciók, és ez egy újabb lépés lehet abba az irányba, hogy a kronológiai életkorunk helyett egyre inkább az öregedési órákkal mérhető biológiai korunk váljon fontossá.
Kapcsolódó cikkek