Forradalmi áttörést hozhat a rák gyógyításában egy magyar cég algoritmusa
A rákellenes világnapon, február 4-én a budapesti székhelyű Oncompass Medicine nyerte el a DigitalEurope, a digitális ipar szereplőit tömörítő szervezet komoly elismerését, a Future Unicorn innovációs díját. A díj azt jelzi, hogy a társaság látja a potenciált abban, hogy a magyar cég a jövőben akár egymilliárd dollárra értékelt techóriássá nője ki magát. A díj technológiai óriáscégekhez és más potenciális befektetőkhöz nyitja meg a kapukat az Oncompass Medicine előtt.
Rákgyógyítást támogató, RealTime Oncology Treatment Calculator nevű informatikai fejlesztésük lényege, hogy a tumorokban detektált génhibák alapján a szűk mesterséges intelligencia mélytanulási módszerével algoritmusuk kiválassza azokat a lehetséges gyógyszer-hatóanyagokat, amelyekkel az adott génhibák a leghatékonyabban semlegesíthetők. Ezáltal a rákos betegeknek nagyobb esélyük nyílik a felgyógyulásra. Technológiájukról, a személyre szabott terápiákról és a szabályozási környezetről beszélgettünk Peták Istvánnal, az Oncompass Medicine alapítójával és ügyvezető igazgatójával.
Hogyan, milyen körülmények között indult el az Oncompass Medicine?
Kutatóorvosként az Egyesült Államokból jöttem haza Magyarországra, kollégám pedig Svájcból, és az volt az álmunk, hogy legyen egy kutatóorvosi-biotechnológiai cégünk Budapesten, amelyik segíti a hozzáférést a személyre szabott orvoslás területén elért tudományos eredményekhez.
A céget 2003-ban alapítottuk, a Humán Genom Projekt évében, vagyis amikor először sikerült feltárni a teljes emberi genomot, és izgalmas volt számunkra, hogyan lehet ezt az információt betegek gyógyítására használni. Az évek során kiderült, hogy a tudományos várakozásokkal ellentétben a genomika lassabban fejti ki hatását az életünkre, de az onkológia pont az a terület lett, ahol ez tényleges áttörést hozott. Tudtuk, hogy a daganatokat génhibák okozzák, és mivel a normális szekvencia elérhetővé vált, elindult a verseny, hogy minél gyorsabban találjuk meg a tumorok génhibáit. Először tehát olyan diagnosztikai technológiák fejlesztésére összpontosítottunk, amelyek képesek kimutatni a daganatokban a láthatatlan mutációkat. Majd amikor nyilvánvalóvá vált, hogy valójában közel hatmillióféle mutáció okozhat daganatot és ebből minden betegben négy-ötféle van jelen, közben több mint száz gyógyszer ezeket a géneket veszi célba, rájöttünk, hogy a következő kihívás a legjobb gyógyszer kiválasztása lesz. Öt éve kezdtünk el teljesen arra koncentrálni, hogy mesterséges intelligencia alapú algoritmust fejlesszünk ennek megoldására.
Technológiánk 3-4 évvel előzi meg a nemzetközi mezőnyt. A világ most ott tart, hogy egyesével próbálják összekapcsolni a génhibákat a gyógyszerekkel, az Oncompass bonyolult, hálózati kapcsolatelemzéssel működő szoftvere viszont a mesterséges intelligencia logikájával képes megmondani, hogy ha egy betegnek öt génmutációja van egyszerre, mégis melyik lenne az a gyógyszer, amellyel a legtöbb génhiba hatását lehet semlegesíteni. Sőt, a folyamatos tanulási képességének köszönhetően ahogy egyre több esettel találkozik a jövőben, egyre nagyobb hatékonysággal választja ki a megfelelő módszert.

Az algoritmusok hatékonyságához nagy mértékben hozzátesz, hogy milyen és mekkora adatbázisokon tanítják ezeket. Milyen adatokon tanul az Oncompass szoftvere?
Nehéz megbízható és kiterjedt adatbázist összeállítani, amely tartalmazza a betegek hosszú távú, terápiás adatait, és ha vannak is ilyenek, azok általában nem elég nagyok. Mi ezért először egy olyan, ok-okozati összefüggésrendszert lefedő rules engine szoftvert raktunk össze, amelyik már kisebb adatbázisokon is képes tanulni. Ez után válik lehetővé, hogy a rendszer a mesterséges intelligencia elérésének egyik módszerével, mélytanulással dolgozzon. Jelenleg a saját betegadatbázisunk több tízezer betegadatot tartalmaz, és szerencsére vannak olyan nemzetközileg publikált, anonimizált adatbázisok, amelyeket szintén tudunk használni. Nagyobb adatbázisokkal persze gyorsabban tudnánk haladni, de már a meglévő rendszer is tudja javítani a döntés hatékonyságát.
Hogyan mérték fel ezt a hatékonyságot?
Tavaly a párizsi Curie Intézettől megkaptuk a világ első precíziós onkológiai klinikai vizsgálatának eredményeit. Ebben a vizsgálatban célzott gyógyszerekkel kezeltek rákos betegeket úgy, hogy a terápiás döntéseket orvosok elemezték a jelenleg használatos módszerekkel és egy olyan algoritmus segítségével, amelyik egyesével párosította a génhibákat a potenciális gyógyszerekkel. Megvizsgáltuk és elemeztük az adatokat a saját szoftverünkkel, és kiderült, hogy a gép használatával az orvosok nagyobb eséllyel választották volna ki a hatásos terápiákat.
Az elmúlt két évben már körülbelül kétezer betegnél vetettük be ezt az okos algoritmust, és a pandémia sem változtatta meg alapvetően a folyamatot. Először az online esetmenedzsment szoftver összegyűjti a betegadatokat, molekuláris diagnosztikai vizsgálati eredményeket (ha nincs, akkor megszervezzük, hogy legyen). Ezután ráengedjük az adatokra az algoritmust, majd a rák genetikájához értő molekuláris biológus vagy infobionikus megvizsgálja, hogy milyen tudományos bizonyítékokat talált az adott génhibákhoz a rendszer, és azt is, milyen javaslatokat tett a gép.
Ezt az eredményt a koronavírus-járvány óta egy virtuális onkoteam keretében ismertetjük a beteg helyzetét ismerő klinikus onkológussal. Megvitatjuk, mit gondolunk mi emberek erről a betegről, mit gondol a gép, és mi van a beteggel. Ebből alakul ki egy végső terápiás javaslat. Az algoritmus tulajdonképpen csak egyetlen szempontot hoz be a sok közül, és ezt az orvosok felülbírálhatják.
Így nem fordulhat elő, hogy az ember nem vesz észre valamit a több ezer információból, amely befolyásolhatja a terápiás döntést. Egyébként ez hasonló például a mammográfiás leletek kiértékeléséhez, amelynél mára a szűk mesterséges intelligencia alapú gépi látást használják. Tipikusan eddig egymástól függetlenül két radiológus értékelte ki a képeket, most pedig az egyik radiológust cserélte le az algoritmus, de ugyanúgy, mint eddig, ha a két vélemény között különbség van, akkor jön egy harmadik. Tehát a gép plusz szakértőként lép fel, de nyilván a csapat dönt utána.
Nem áll fenn a veszélye, hogy túlzottan a gépre hagyatkoznak majd az orvosok?
Ahogy egyre több bizonyítékot találunk arra, hogy mik azok az indikációk és helyzetek, amikor a gép a legnagyobb valószínűséggel dönt jól, az orvos egyre jobban el tudja dönteni, hogy az adott helyzetben mennyire hallgathat erre a tanácsra. Habár nagyon ijesztően hangzik, az egész semmiben sem különbözik mondjuk egy mikrobiológiai teszttől, amely megmondja, hogy a baktérium melyik antibiotikumra a legérzékenyebb. Olyan gépet fejlesztünk, amelynek nagyon keskeny az intelligenciája. Keskeny, de mély. Arra az egy információra koncentrál, hogy a génhibák alapján melyik gyógyszerre érzékeny a daganatsejt, de ez még csak egy információ a sok közül.
Sokak félelmével szemben tehát ez az algoritmus nem kívánja lecserélni az orvost. Erre voltak ugyan próbálkozások a világban, de azok sorra megbuktak. Az orvoslásban az embert nagyon nehéz lenne végig géppel helyettesíteni, és ez nem is cél. A rákgyógyításban egyébként továbbra is inkább az a nagy, megoldatlan probléma, hogy nem tudjuk időben diagnosztizálni a daganatokat.
A rákos megbetegedésekre vonatkozó magyar statisztikákat elnézve fel is merül a kérdés, hogy mennyire elérhetőek az Oncompass Medicine szolgáltatásai egy átlag magyar beteg számára.
Jelenleg egyrészt magánellátásban, másrészt az onkoteam javaslatára a Nemzeti Egészségbiztosítási Alap (NEAK) egyedi méltányossági eljárásán keresztüli támogatással elérhető, mint minden új, befogadásra váró orvostechnikai eszköz és gyógyszer. Maga az ellátás molekuláris diagnosztikával és orvosi konzultációkkal együtt magánkeretek között egymillió forint körül van.
Ez nyilván nagyon kényes dolog, mert az lenne az optimális, ha minden daganatos beteg térítésmentesen férhetne hozzá minden új orvosi technológiához és gyógyszerhez. Ezért mindent megteszünk, amit tudunk. Jelenleg 18 új gyógyszer is befogadásra vár az Innovatív Gyógyszergyártók Szövetségének adatai szerint. A technológiai értékelés, az új eljárások és gyógyszerek magas költsége miatt ez természetesen a világon mindenhol probléma. Sokszor évekig tart. Ezt is szeretnénk az informatikai eljárásunkkal felgyorsítani.
Mi kellene ahhoz, hogy az onkológiai döntéstámogató rendszert befogadja a NEAK?
Az informatikai elemző módszer és az ahhoz szükséges molekuláris diagnosztikai vizsgálat, amelyek így együtt alkotnak egy precíziós onkológiai eljárást, már átment a technológiai értékelés folyamatán, megnézték, mennyire hatékony és költséghatékony, ennek alapján pedig egészségügyi közgazdászok kikalkulálják, hogy az egészségnyereség arányban áll-e a költségekkel. Ez alapján állapodik meg a szolgáltató és a NEAK a finanszírozás feltételeiben. Ennek megvannak a szakmai szabályai, és ez az elemzés már meg is történt, csak a bevezetésre várunk.
Tulajdonképpen kérdés az, mennyire prioritás, hogy Magyarországon azonnal befogadásra kerüljenek a legújabb technológiák. Természetesen mint magyar innovatív orvostechnológiai cég szeretnénk ezért mindent megtenni, hiszen az nagyon szép, hogy külföldön egyre többen érdeklődnek utána, de azért az lenne a jó, ha Magyarországon hozzáférnének a betegek. Az természetesen bonyolult szakmai kérdés, hogy pontosan milyen indikációban és hány betegnek a legindokoltabb egy új orvosi módszer finanszírozása. Ennek a döntésnek szakmai érveken kell alapulnia. Ez egyébként nemzetközi probléma is - olyan gyorsan jönnek ki az új gyógyszerek és az új technológiák, hogy a döntéshozók nagyon nehezen tudják követni őket.
Viszont az Európai Uniónak a DigitalEurope díjátadóján konkrétan javasoltam, hogy legyen egységes európai értékelés, szóval ha egyszer megállapítják valamiről, hogy hatékony és költséghatékony, akkor már az egyes tagállamok biztosítóival külön-külön ezt ne kelljen végigzongorázni. Most ezt igyekszünk elérni. Ez egyébként Európában borzasztóan megakasztja az innovációt: minden országban más a szabályozás, ráadásul egyes országokban több biztosító is működik, szemben az Egyesült Államokkal, ahol óriási tömegeket lehet egyetlen fejlesztéssel elérni. A Medicare befogadása például rögtön 300 millió emberből álló ország daganatos betegeinek többségét jelenti, hiszen a daganatok többsége idősebb korban jelentkezik. Ez nem összehasonlítható az EU-val, és ezt valahogy meg kell változtatni. Elfogadhatatlan, hogy miközben csodálatos gyorsasággal haladnak a genomikai kutatások, mesterséges intelligenciát fejlesztünk, majd adminisztratív gátjai legyenek annak, hogy a betegek hozzáférjenek a legmodernebb technológiáknak.
Óriásinak tűnik a távolság a jövőbe mutató technológiák és a magyar egészségügy között. Egy Oncompass-féle cég mit tud kezdeni ezzel az ellentmondással?
A technológiánk hazai bevezetése azért is lenne fontos, mert segíthetné a célzott rákgyógyszereknek a gyors befogadását és optimális használatát is. Vagyis az Oncompass segítségével gyorsan el lehetne dönteni, kinek érdemes egy-egy nagyon drága gyógyszert adni. Egy célzott kezelésnek ugyanis havonta átlagosan 10 ezer dollár a költsége, vagyis havonta körülbelül 3 millió forint. Ez döbbenetesen nagy költség. Az éves innovatív onkológiai gyógyszerköltség Magyarországon körülbelül 100 milliárd forint. Bele lehetne gondolni, mit jelentene, ha mi a hatékonyságon csak 10 százalékot is tudnánk javítani, és így ugyanannyi pénzből még nagyobb “életnyereséget” lehetne biztosítani.
Említette, hogy Magyarországon és az EU piacán is nehézségek akadnak a piacra lépéssel. Nem gondolták, hogy inkább elviszik Magyarországról a céget például az Egyesült Államokba?
Izgalmas kérdés, nyilván ott gyorsabban tudnánk növekedni, és ezért az amerikai piacot is célba kell vennünk, de mindent megteszünk, hogy legalább a kutatás-fejlesztés és az innováció központja mindig Magyarországon maradjon. A szentimentális okokon túl azért, mert itthon nagyon jó munkatársakat találunk. Sok a lelkes, tehetséges frissen végzett biológus, informatikus, infobionikus, ami abszolút alkalmassá teszi Magyarországot a kutatás-fejlesztésre.
Igazából minden megvan, csak a piac hiányzik, de a digitális világ most ebben is lehetőséget ad. Nem biztos, hogy most már akkora az előnye annak, ha az ember a Szilícium-völgyben van fizikailag, ha egyébként minden Zoomon zajlik. Mindegy, hogy San Franciscóban vagyunk vagy Budapesten, hiszen minden digitális lett: a konzultációk, az orvosok együttműködése, minden jól működik az online térben is.
Kapcsolódó cikkek a Qubiten:

Hatalmas magyar siker: rákgyógyítást támogató hazai cég nyerte a DigitalEurope innovációs díját
Az Oncompass Medicine rákos daganatokban azonosított molekuláris genetikai elváltozások alapján ajánl személyre szabott terápiát. A Future Unicorn díj azt jelzi, hogy a digitális iparág európai szakmai szervezete látja a potenciált a cégben arra, hogy a jövőben egymilliárd dollárra értékelt techóriássá váljon.
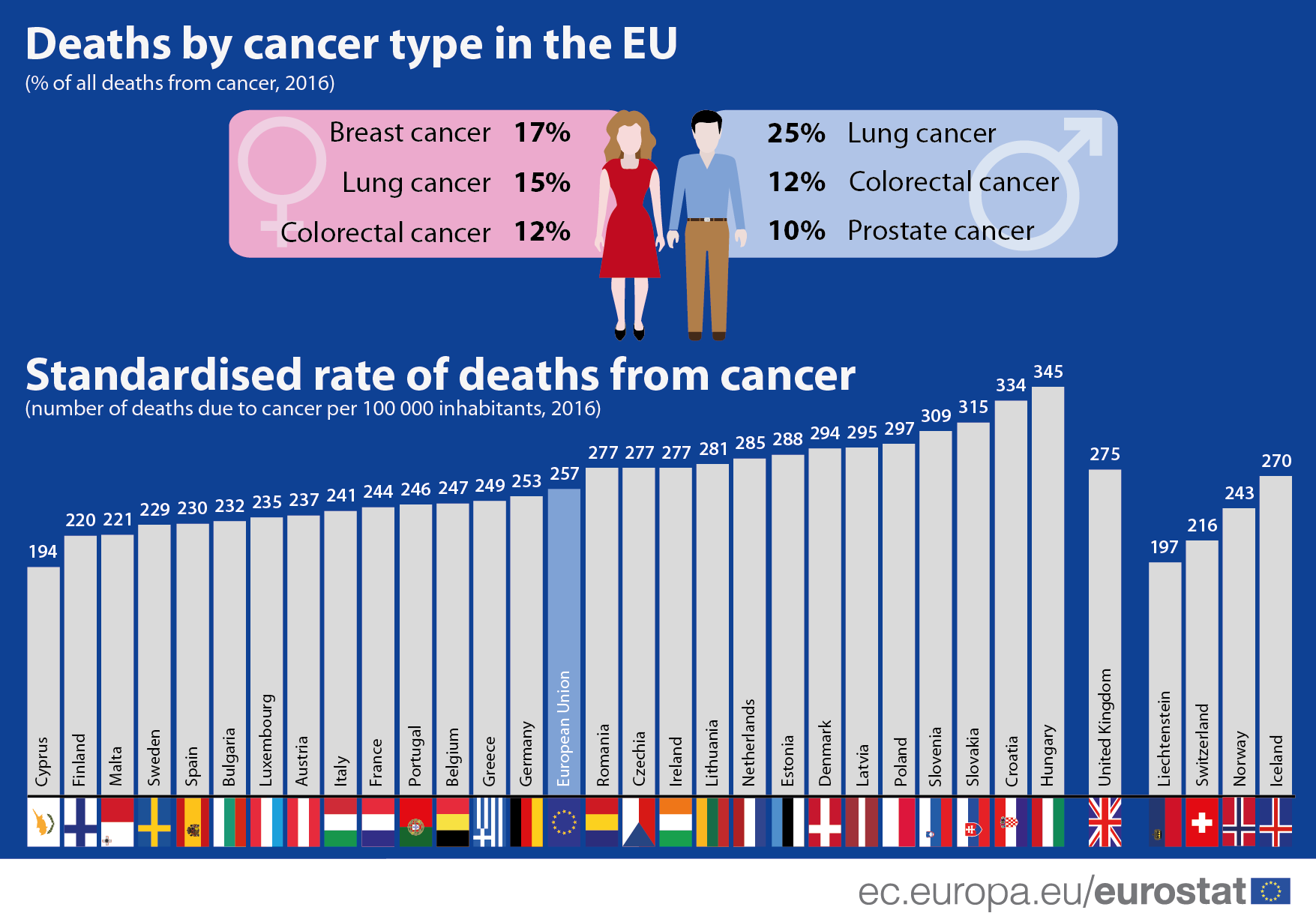
Magyarországon a legmagasabb a rák miatti halálozási ráta az unióban
Az Európai Unióban 2016-ban már a halálesetek több mint negyede következett be rák miatt. Magyarország évek óta vezeti a rákhalálozási rátát, de egy picit nálunk is javult az arány.
