Már hónapokkal előre kimutatható, milyen mutációkat tartalmaz majd a koronavírus következő variánsa

Mióta 2019 végén megjelent, a SARS-CoV-2 koronavírus jelentős evolúción ment keresztül, ami folyamatosan megnehezíti a vírussal szembeni védekezést, hiszen az így létrejött variánsok könnyebben kijátszhatják az oltások vagy a korábbi fertőzés által megszerzett immunitást. Ezért rendkívül hasznos lenne bármiféle előrejelzés arra nézve, hogy milyen genetikai változások, azaz mutációk terjedhetnek el a vírus evolúciója során, és azok milyen problémákat okozhatnak a jövőben.
Egy friss, a Science Translational Medicine egészségügyi folyóiratban közölt tanulmány pontosan erre vállalkozik: megjósolja, hogy a vírus meglévő mutációi közül melyek járulhatnak hozzá újabb variánsok kialakulásához. A San Franciscó-i Vir Biotechnology kutatóinak vizsgálata azt is feltárta, hogy a koronavírus evolúcióját – változó sorrendben – a vírus sejtbe jutásához szükséges ACE2 receptorhoz való kötődés erőssége, valamint a közösségi immunitás megkerülése vezérli.
Azt természetesen a tanulmány vezető szerzője, Cyrus Maher és kollégái is rögzítik, hogy ismeretlen mutációk felbukkanásának vagy a vírusok evolúciójának általános előrejelzése nem lehetséges. Azonban néhány hónappal előre már fel lehet tárni, hogy milyen mutációk terjedhetnek el a legnagyobb valószínűséggel, annak megfigyelése alapján, hogy megjelenésük után hogyan teljesítettek. Mivel a legtöbb mutáció nem különösebben befolyásolja a vírus viselkedését, a kutatók úgy vélik, módszerük elsősorban annak megállapítására alkalmas, hogy mely változásokat érdemes alaposan megvizsgálni funkcionális hatásuk szempontjából.

Csak a vírus tüskefehérjéjén (S-fehérje), amely a vírus sejtbe jutásának folyamatáért felel, közel 10 ezer mutációt észleltek két év alatt, 2021 decemberéig, így Maher és kollégái elsősorban azt igyekeztek kideríteni, hogy ezek közül melyek jelenhetnek meg nagy valószínűséggel újabb vírusvariánsokban.
A kutatók az egyes mutációk sikerességének vizsgálatához epidemiológiai, biokémiai, evolúciós és immunológiai adatokat használtak fel, valamint a nemzetközi adatbázisokban elérhetővé tett rengeteg koronavírus-genomot, amelyek a vírusfehérjék sejtek általi legyártáshoz szükséges információt hordozzák. A mutációk terjedését több országban figyelték meg, két időszakban (2020 januárjától márciusáig, valamint 2021 júniusától augusztusáig), ami egybevágott kevésbé ismert mutációk, valamint veszélyes variánsok terjedésével is.
A legpontosabbnak az epidemiológiai adatokon alapuló modell bizonyult, amely a különböző országokban vizsgált vírusokban felbukkanó mutációk számát és gyakoriságát direktben adta meg, egy „epi érték” nevű változó segítségével. Az epi érték az újra és újra előforduló mutációkat és egyes evolúciós leszármazási vonalak elterjedését vette figyelembe, így jól összegezni tudta a vírus evolúciós rátermettségét hajtó, időben is változó szelekciós tényezőket. A modell további előnye lehet a viszonylag kis számítási igénye – a kutatók szerint egyetlen laptop több millió vírusfehérje-szekvenciát képes átvizsgálni egy nap alatt.
Az epi értékekkel több hónappal előre, nagy pontossággal meg tudták határozni azokat a mutációkat, amelyek aztán elterjedtek a vírus fejlődése során, annak újabb és újabb variánsaival. Arra is fény derült, hogy az egyes mutációk terjedéséért inkább globális, és nem egy országon belüli folyamatok felelősek. Az előrejelzés hatékonyságára a potenciálisan antitestek kicselezésében résztvevő Y145H mutációt hozták példának, amelynek terjedését 2021 júliusában jelezték előre a kutatók. Ez később, 2021 októberében a delta variáns egyik változatának, az AY.4.2-nek az egyik legfontosabb mutációjává vált, és ekkor a Nagy-Britanniában vett minták 8,5–11,3 százalékáért ez a változat felelt.
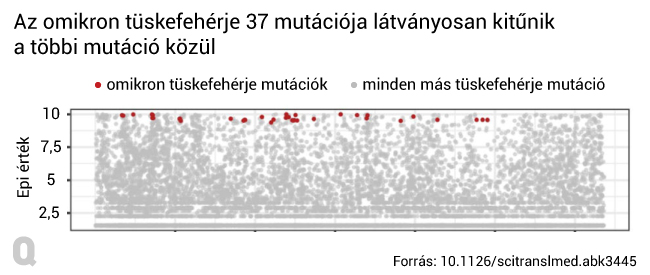
A módszer tehát arra is kiterjeszthető, hogy előre jelezze a jövőben felbukkanó variánsok főbb mutációit – ezt Maher és kollégái le is tesztelték az omikron variáns példáján. Kiderült, hogy az omikron tüskefehérjéje által hordozott fontosabb mutációk a kutatók modelljében is fontosabbnak tűntek (vagyis jelentősen magasabb epi értékkel rendelkeztek) más mutációkhoz képest, még az omikron felbukkanása előtt. Annak ellenére, hogy a kutatók szerint a variánsok sikerességét nehéz megjósolni, az jól látszik, hogy azokat magas epi értékű, azaz a vírus számára evolúciós előnyt jelentő genetikai változások fogják többnyire jellemezni. A kutatók értelmezése szerint az omikron egyes mutációi eleve hasznosak lehettek a vírusnak, mielőtt együtt megjelentek volna egyetlen variánsban.
Maherék ezután megvizsgálták, hogy mi az egyes, éppen terjedő mutációk hatása a covid kezelésére alkalmazott monoklonális antitest-terápiákra. 2021 októberéből származó adatokból kiderült, hogy a celltrion antitest-terápia hatásosságát tíz, már megjelent tüskefehérje-változás is befolyásolhatja. Az eleve a vírus evolúciójával szemben ellenállóbbá tervezett sotrovimabot csak két olyan, tavaly októberben alacsony gyakoriságú mutáció érintheti, amely nem csökkenti az antitestek vírusneutralizáló képességét.
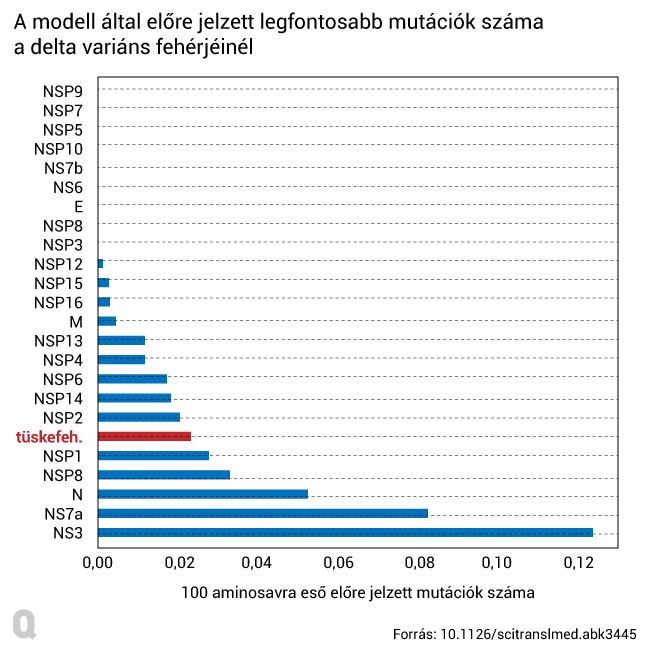
Miután a kutatók kiterjesztették mutációs vizsgálatukat a delta variáns összes fehérjéjére, világossá vált, hogy nem szabad csak a koronavírus tüskefehérjéjének (S-fehérje) változásaira figyelni. Összességében 151 azonosított, evolúciós szelekció alatt álló mutációt találtak, a legnagyobb mutációsűrűséget pedig a vírus NS3/ORF3 nevű kiegészítő fehérjéjén tapasztalták, amely részben a sejtek által a fertőzés további terjedésének megállítása érdekében termelt interferon megkerüléséért felel. A tüskefehérjén átlagos mutációs sebességet észleltek, itt 2,3 mutáció jelent meg 100 darab aminosavra lebontva. A modell szerint a legfontosabb mutációk a G142D és T951 jelzésűek lehetnek, amelyeket a delta variáns tüskefehérjéjén a magasabb vírusszinttel hoztak összefüggésbe.
Maher és kollégái úgy vélik, elsősorban azt kell vizsgálni, hogy a vírus S-fehérjéjén kívüli fehérjéket érintő mutációk milyen hatással vannak a veleszületett immunválasz kicselezésére és a vírus replikációjának javítására, és az új modelljük ebben segíthet. A modellt ezenfelül ki lehet terjeszteni más vírusok evolúciójának követésére is, például a rendkívül gyorsan változó influenzavírusokra – ehhez mindössze megfelelő mennyiségű, feltárt vírusgenomra van szükség.
Kapcsolódó cikkek a Qubiten:
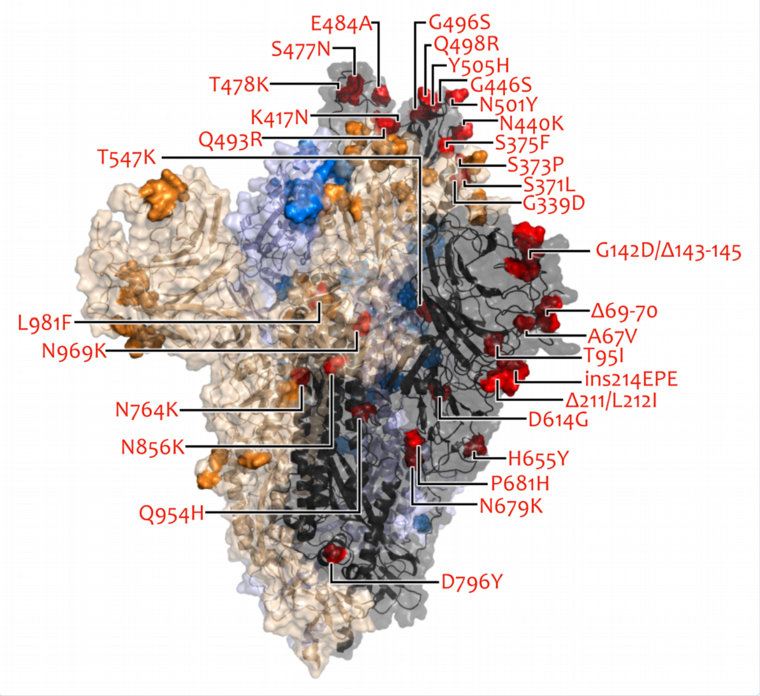
Látványosan sok aggasztó mutációval rendelkezik az omikron, de még nem tudni, milyen lesz az együttes hatásuk
Elképzelhető, hogy az új vírusvariáns egy vagy több immunhiányos betegben, krónikus koronavírus-fertőzés során alakult ki, de az is lehet, hogy újabb zoonózis eredménye, vagyis az emberről egy ismeretlen állatfajra került, és onnan jutott vissza az emberi populációba. Az oltások valószínűleg továbbra is védenek a súlyos betegség ellen, és feltehető, hogy a gyógyszerek hatásossága sem csökken.
Megeshet, hogy mire a vakcinagyártók elkészülnek a variánsspecifikus oltással, el is tűnik az omikron
Kedden csaknem 10 ezer új fertőzöttet regisztráltak Magyarországon, és a fertőzések túlnyomó többségét az omikron okozza. A Pfizer/BioNTech és a Moderna is dolgozik az új vakcinán, de ahogy az új variáns felbukkant a semmiből, úgy el is tűnhet, ami okafogyottá teheti a speciális oltás kifejlesztését.
Biológiai alapelvet írhat át egy friss kutatás: mégsem véletlenszerűek a DNS mutációi
A genetikusok egyik kedvenc modellélőlénye, a lúdfű vizsgálata meglepő dolgot tárt fel: kiderült, hogy a DNS-ében keletkező káros mutációkból kevesebb van a genom fontos részein. Bár az elfogadott álláspont szerint a mutációk véletlenszerűek, már eddig is voltak jelei, hogy ez az alapelv elavult.