8 milliárdos befektetést kapott a magyar cég, ami szimulált sejtmodellel reformálná meg a rákgyógyszergyártást
20 millió euróval, azaz több mint 8 milliárd forinttal támogatta a héten a világ egyik legismertebb gyógyszergyára, az Egyesült Államokban Merck & Co., azon kívül MSD néven ismert vállalat és a Mercia kockázatitőke-befektető a magyar Turbine.AI biotechnológiai céget, ami mélytanuló algoritmusokkal megtámogatott sejtszimulációs platformjával és szimulált gyógyszerkísérletek millióival igyekszik lerövidíteni a gyógyszerfejlesztés sokszor évtizedekig tartó folyamatát. A magyar vállalat célja, hogy olyan fehérjecélpontokat találjon, amelyekből hatékony rákgyógyszereket lehet fejleszteni.
„Amik a biológiából eddig hiányoztak, viszont a mérnöki területeken megvannak, azok a számítógépes tervezőprogramok (CAD). Amikor egy vadászrepülőt próbálsz építeni, nem lehet először mindent megépíteni, majd kipróbálásra betenni a szélcsatornába, hogy hátha működik, hanem jó, ha van egy szimulátor, ahol rengeteg dolgot előre ki tudsz találni, és azután lehet a legjobbnak tűnő 2-3 dolgot ténylegesen megépíteni, és rákölteni rengeteg pénzt és erőforrást. Mi egy ilyen típusú biológiai szoftveren dolgozunk” – mutatta be a technológiát a Qubitnek Szalay Kristóf, a Turbine.AI egyik alapítója és technológiai vezetője.
A mostani befektetést a következő egy-másfél évben a cég arra tervezi fordítani, hogy házon belül saját labort alakítson ki, ahol in vitro kísérletekben is kipróbálhatják az eddigi sejtszimulációs kísérleteik során már megtalált potenciális gyógyszercélpontokat, és a jövőben majd eljuthatnak a klinikai vizsgálatok előkészítéséig. A befektetés azért jelentős, mert a biotechnológiai startupok világszintű éves befektetési összegei a tavalyi 71,8 milliárd dollárról idén 24,4 milliárd dollárra estek vissza, az európai piacon pedig 2020 óta a kockázatitőke-befektetők mintegy 18 milliárd dollárt öntöttek biotech cégekbe, és ez az összeg befektetési szempontból az európai biotechnológiai startupok középmezőnyében helyezi el a Turbine.AI-t.

Több milliárd dollár is kirepülhet az ablakon eredmény nélkül
Normál körülmények között egy gyógyszer kifejlesztése körülbelül 10-15 évet ölel fel, amikor is egy adott betegség ellen a laborban kikísérleteznek egy potenciális hatóanyagot, majd először állatokon, később pedig három klinikai fázison keresztül egyre nagyobb embercsoportokon tesztelik, hogy biztonságosan és tényleg hatásosan vegye fel a harcot az adott betegség ellen. A folyamat költsége átlagosan 1-2 milliárd dollárba, sikerrátája viszont elképesztően alacsony: 2010 és 2017 között a klinikai vizsgálatok adatai alapján a gyógyszerfejlesztési próbálkozások 90 százaléka sikertelenül zárult. 40-50 százalékban nem működött a tesztelt hatóanyag, 30 százalékban nem tudták leszorítani a magas toxicitást, vagyis nem volt biztonságos a betegek számára, 10-15 százalékban más tulajdonságai nem váltak be gyógyszerként, de 10 százalékban olyan is előfordult, hogy nem volt kereslet a hatóanyagra, esetleg rosszul tervezték meg a marketingstratégiát.
A rákterápiás gyógyszerek fejlesztésének sikerrátája még alacsonyabb: 1-2 százalék körül mozog. Elsősorban ez az oka annak, hogy ezek a gyógyszerek a betegeknek akár több millió forintba is kerülhetnek: a gyógyszercégek a sikertelen fejlesztési folyamat költségeit is belekalkulálják az árba.
A fenti statisztikákból látszik, hogy a gyógyszefejlesztések 70-80 százaléka a nem megfelelő hatóanyagon bukik el. Ha egy kicsit mélyebbre ásunk a gyógyszerhatóanyagok világában, itt a sejtek működésének legalább 95 százalékáért felelős fehérjék játsszák a főszerepet. A gyógyszercégek olyan hatóanyagokat igyekeznek találni, amelyek egy adott betegségért felelős fehérjéhez hozzákötődve képesek megváltoztatni annak működését, és így meggyógyítani az adott betegséget. A probléma ott kezdődik, hogy több tízezer emberi fehérje létezik, amelyek bonyolult hálózatban működnek, és óriási kihívást jelent megtalálni azokat a molekulákat, amelyek valóban hatnak egy adott fehérjére, és még azt is garantálni, hogy az emberi szervezetben se okozzanak kárt.
Ez az a pont, ahol segít az algoritmusokat alkalmazó biotechnológiai cégek, így a Turbine.AI sejtszimulációs platformja. A covid elleni vakcinák kifejlesztésének első lépcsőjéhez egyébként a biotechnológiai cégek szintén algoritmusokat használtak a vakcinafejlesztési folyamat lerövidítéséhez, és mesterséges intelligenciát használó módszerrel dolgozik az amerikai Atomwise nevű cég is. „Ők pár évvel előttük járnak, és többször tanultunk tőlük. Kicsit más, amit csinálnak. Abban más, hogy ha már tudod, hogy mi az a fehérje, amit te szeretnél célba venni, de nem tudod, hogy mivel célozd meg, ők megcsinálják hozzá a molekulát. Ők inkább kémiai, mi biológiai cég vagyunk” – mondta Szalay.
Mire jó a sejtszimuláció?
„Amit mi látunk a sejtből, az egy nagy gráf. Azt nézzük, hogy a fehérjék hogyan vannak összekötve egymással, de nemcsak ránézünk magasról, mint egy térképre, hanem vissza is tudjuk játszani az interakciókat, mint egy mozit. Ha én az egyik fehérjét kiveszem vagy legátlom, el fog indulni a sejtben egy reakciós folyamat: ez a fehérje egy másik fehérjét aktivál, és így tovább, míg a végén ebből összeáll egy sejtválasz. Az is lehet, hogy nem csinál semmit, hanem békésen szaporodik tovább, de az is lehet, hogy elindítja például a ráksejteknél kívánatos sejthalálhoz vezető folyamatokat, vagyis bekapcsolja azt az önmegsemmisítő programját, amit a ráksejtek általában kikapcsolnak magukban. Észreveszi magáról, hogy sérült a sejt örökítőanyaga, észreveszi magáról, hogy ő egy ráksejt, és elpusztítja magát” – mondta Szalay.
Hozzátette, hogy minden egyes sejtünkben teljesen ugyanaz a genom van, de más fehérjék vannak bekapcsolva, így minden sejt egy kicsit máshogy néz ki. A Turbine.AI a szimulációkor először kiválasztja, hogy a könyvtárukban lévő több ezer fajta sejt közül melyikkel dolgozzon a szoftver, majd azt, hogy milyen gyógyszert adnak neki, vagy melyik gént kapcsolják ki. A szimuláció ezt a kettőt összerakja, és megmondja, hogy ha ezek a bemeneti paraméterek, akkor ez lesz az eredmény.

Fehérjékről álmodik a tanuló algoritmus
Az emberi sejtben zajló folyamatok mérése rendkívül bonyolult. „Ezek a fehérjék nagyon ficánka lények, aprók, folyamatosan mozognak, rugalmasak, ráadásul, ha szeretnénk őket megmérni, és kivesszük őket egy vizes oldatba, akkor szétplöttyednek. Bármi, amit így mérni fogunk, az nem ugyanaz lesz, mintha a fehérje a sejtben maradt volna. Szóval pont az a nagyon fontos adat, ami ahhoz kell, hogy szimulálni tudjuk, hogy két fehérje hogy működik együtt, ha összekapcsolódnak, gyakorlatilag nagy skálán mérhetetlen. Bizonyos környezetben hónapok alatt egy-egy interakciót le lehet mérni, és léteznek kisebb modellek 50-100 fehérjére, de ennél nagyobbak nincsenek” – mondta Szalay.
Ahhoz, hogy összerakjanak egy szimulált sejtet, amit aztán mindenféle sejtre alkalmazni lehet, nem volt elég, hogy behúzzák azt a tudást, ami a biológiakönyvekben van, mivel a fehérjefolyamatokról meglévő információhalmaz még eléggé hiányos – itt jöttek a képbe a mélytanuló algoritmusok. „Nem vagyunk hagyományos mesterséges intelligenciát használó cég, tehát nem azt csináljuk, hogy fogunk egy csomó adatot, beleöntjük egy szoftverbe, ráküldjük az algoritmust, és megvárjuk, mi jön ki a túloldalon predikcióként. Mi a mesterséges intelligenciát arra használjuk, hogy kitaláljuk, mik a szimuláció hiányzó paraméterei, például milyen erősen kötnek egymással a fehérjék” – mondta Szalay.
Ezért először létrehoztak egy tanuló adatbázist, amelyen megtanították az algoritmusnak a már ismert folyamatokat: ha egy adott gént kikapcsolunk a sejtben, akkor az a sejt életben marad-e, és ha igen, hogy fog kinézni utána. „Ebből van több százezer tanítópontunk, és ezeket használva az algoritmus megpróbálja kitalálni, hogy ha van egy rákos sejt, és azt szeretnénk eredményként kapni, hogy elhaljon, mik lehetnek a hiányzó adatok ahhoz, hogy ez ténylegesen megtörténjen” - magyarázta a Turbine.AI technológiai vezetője.
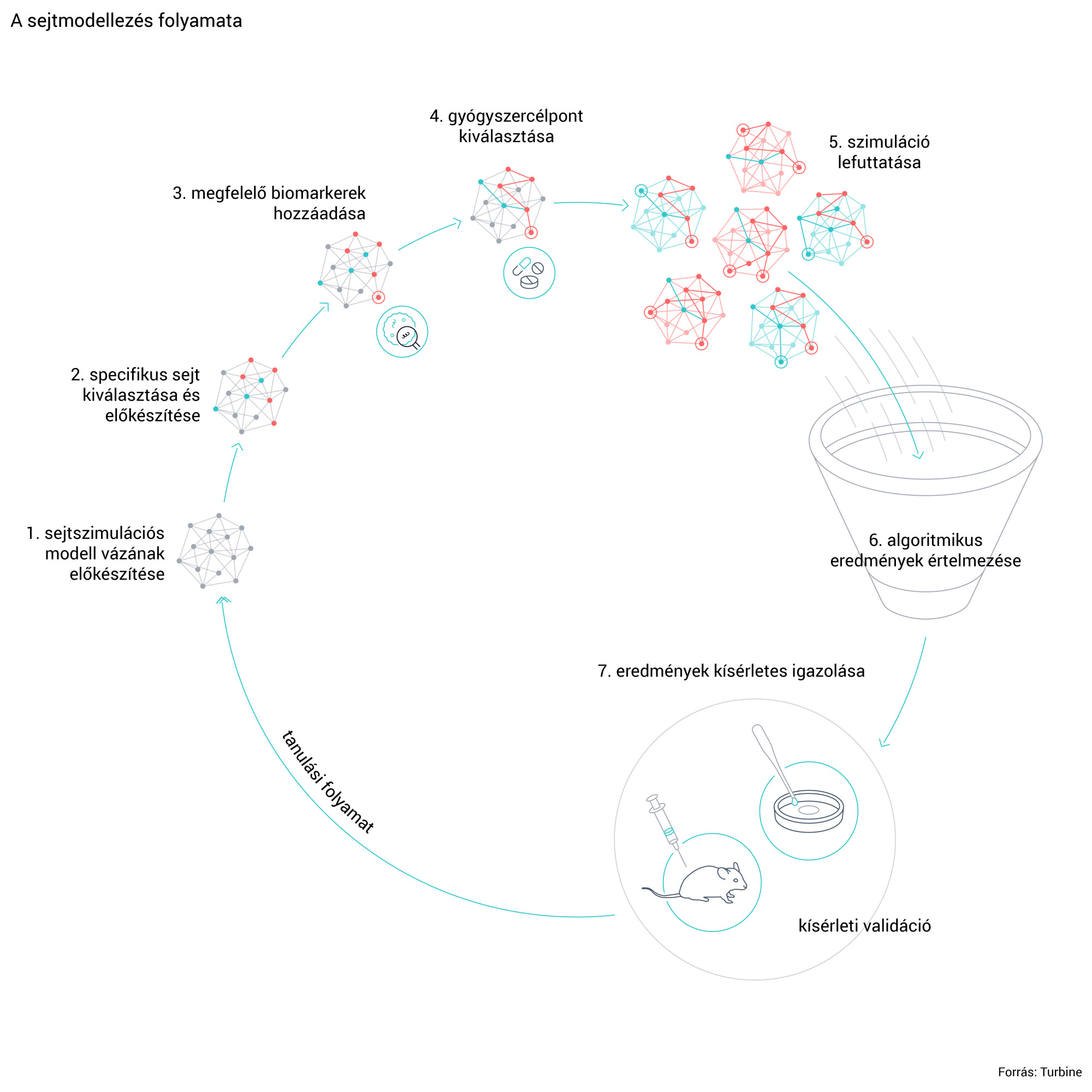
Egy hét alatt százmillió kísérlet
Szalay elmondta, szoftverük pontossága nem mérhető össze például a radiológiai képfelismerő szoftverek képességeivel, azok 90 százalék fölötti pontosságra is képesek, a Turbine.AI algoritmusa által kapott eredmények 66-70 százaléka szokott validálódni. „Csak hogy kontextusba helyezzem, 10 százalék körül mozog annak az aránya, hogy ha adott mutáció van egy sejtben, arra megtalálják a megfelelő gyógyszercélpontot. Ezt tudjuk mi 60 százalékra emelni, de talán még 40 százalék is jó lenne, ebben nem az az érdekes, hanem az, hogy egy kísérlethez képest a szimuláció nagyon gyors. Egy hét alatt 100 millió kísérletet tudunk lefuttatni” - mondta Szalay. Hozzátette, hogy ebből körülbelül 20 petabájtnyi adatot termelnek, ami a CERN napi adatelőállítási teljesítményéhez mérhető.
A szimulált kísérletek lefuttatása után keletkezett óriási adatmennyiséget feldolgozzák, majd az abból megmaradó 1-2 terabájtnyi adat lefordítására külön algoritmusokat vetnek be, hogy az ember számára is értelmezhető eredményeket kapjanak. Ezek mintafelismerő algoritmusok, amelyek azt vizsgálják, hogy egy adott molekulára milyen ráksejtek válaszoltak. „Megnézik, hogy ebben a rengeteg kísérletben van-e valamilyen minta, van-e valamilyen közös vonás. Vannak a BRCA1-mutációval bíró mellráksejtek, tök jó, de lehet, hogy az AKT-mutáns vastagbéldaganat-sejtek is válaszoltak a molekulára" – mondta Szalay, aki szerint innentől kezdve gyógyszertechnikai és üzleti döntés, hogy milyen irányba érdemes elvinni a gyógyszerfejlesztést: vannak-e ilyen betegpopulációk, fejleszt-e erre már valaki más gyógyszert, stb.
BRCA-mutációt hordozó mellráksejt elleni gyógyszer a csőben
A lényeg, hogy laborban lehetetlen ennyi kísérletet végigvinni, mert a folyamat költséges, és a sikerrátája is kérdéses. A Turbine.AI viszont azt tudja mondani a gyógyszercégeknek, hogy elég csak három potenciális gyógyszerjelöltet letesztelniük egereken, és ezek közül valamelyik nagy eséllyel hatásos lesz. Ennek a folyamatnak a sikerességét egyébként ők maguk is igyekeznek megmutatni a gyógyszercégeknek úgy, hogy a sejtszimulációval megtalált gyógyszerjelöltjeiket elvinnék egészen a klinikai vizsgálatok első fázisáig – ennek megvalósítását segíti elő a több mint 8 milliárd forintos befektetés –, és úgy adnák át tesztelésre az erre több erőforrással rendelkező gyógyszervállalatoknak, hogy nekik már nem kell viselniük a hatóanyag-keresés fázisának kockázatait.
„A saját példánkon keresztül szeretnénk megmutatni a gyógyszercégeknek, hogy itt vannak a gyógyszerjelöltjeink, és mi ezt kihoztuk 5 millió dollárból, ami másoknak 50 millió dollárból sikerült. Ennyit tudtok nyerni a szimulációval” - mondta Szalay.
A technológiai vezető elmondta, van már 3-4 belső gyógyszerjelöltjük, és az elsők az állatkísérleteknél tartanak, három éven belül pedig akár betegekbe is kerülhetnek. Az egyik például a BRCA-mutációkat hordozó mellrák elleni gyógyszerjelölt. Erre a mellráksejtre néhányféle kemoterápiás gyógyszer létezik, viszont ha a szervezetben már szétszóródott a rák, a daganat nagyon hamar rezisztenssé válik ezekre a gyógyszerekre – ez a PARP-gátlókra mutatott rezisztencia. Tehát körülbelül egy évet lehet nyerni vele a betegeknél. Szalay elmondta, ők erre a rezisztenciára fejlesztenek jelenleg gyógyszert.
Soha többé állatkísérletek?
Hová lehet eljutni a sejtmodell egyre magasabb fokú pontosításával a jövőben? Szalay szerint nem valószínű, hogy az állatkísérleteket ki lehet váltani. „Amit csinálunk, az a valóság modellje, ez pedig sosem lehet 100 százalékosan pontos. Ha eljutnánk oda, hogy 99 százalékos pontossággal működik, még akkor is érdemes legalább azt az egy kísérletet megcsinálni a biztonság kedvéért, hogy működik-e a predikció”.
Egy ideális világban a covid elleni vakcinák kifejlesztésénél tapasztalt sebességet, tehát körülbelül egy-másfél éves fejlesztési folyamatot szeretne látni a rákgyógyszereknél is, reálisan viszont arra számít, hogy a következő években 12 év helyett 5 évre lehetnek képesek csökkenteni a folyamat idejét.
Emellett Szalay szerint a szimuláció segíthet abban, hogy a vállalatoknak kisebb betegpopulációkra is érdemes legyen gyógyszert fejleszteniük, így sokkal személyre szabottabbá válhat az orvoslás. Még azt is el tudja képzelni, hogy a jövőben a szimuláció a betegágy mellé kerüljön, és tényleg az egyes betegek paraméterei alapján meghatározott hatóanyaggal gyógyítsák az adott daganatot. Egyelőre ettől messze vagyunk, ahogy Szalay másik nagy álmától is, hogy olyan szintre jusson el a biológiai folyamatok megértése, hogy egy májdaganat esetén ne kelljen rákterápiát alkalmazni, hanem az őssejtjekből egyszerűen tudjunk egy új májat növeszteni.
Kapcsolódó cikkek a Qubiten:

Hogy sikerült csodát művelni és kevesebb mint egy év alatt kifejleszteni a vakcinát a koronavírus ellen?
A koronavírusokról az évek során összegyűjtött tapasztalatok, a vakcinafejlesztésbe öntött dollármilliárdok, a kutatók globális együttműködése, valamint a géntechnológia, a mesterséges intelligencia és az mRNS-alapú vakcinaelőállítási technológia mind-mind hozzájárult ahhoz, hogy a történelemben eddig soha nem látott módon, kevesebb mint egy év alatt sikerült kifejleszteni és engedélyeztetni a SARS-CoV-2 elleni oltóanyagokat.
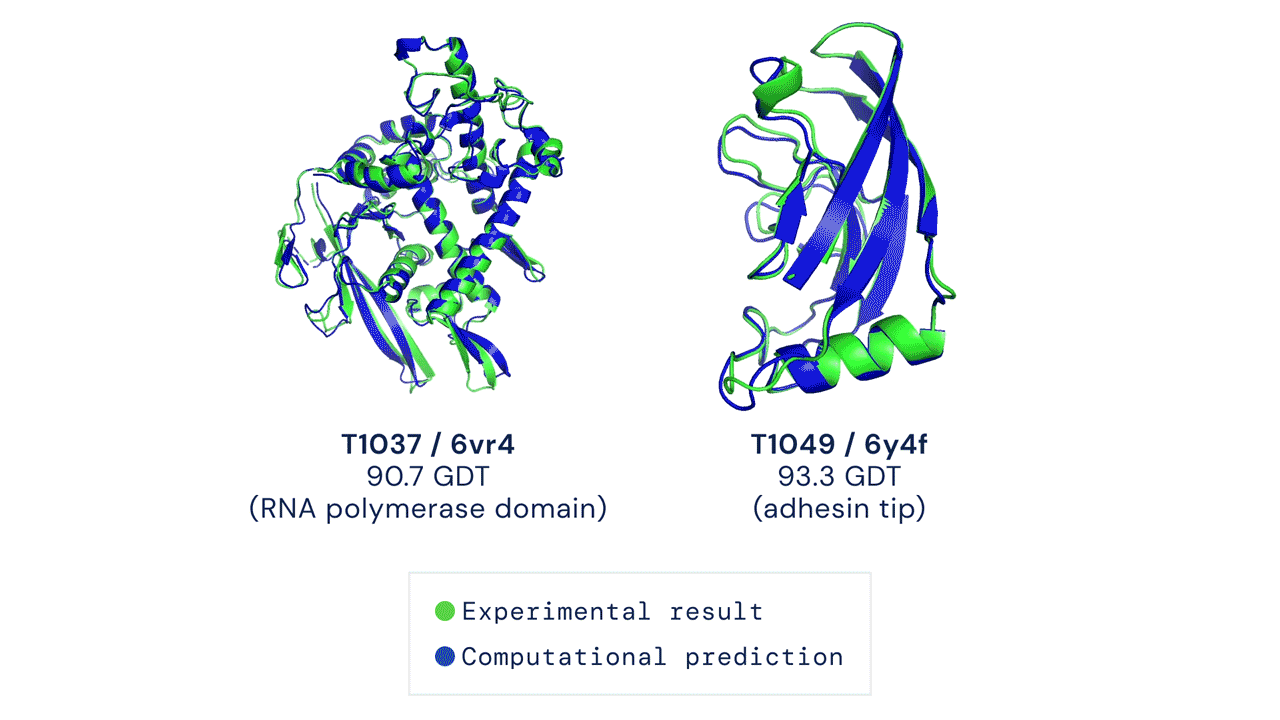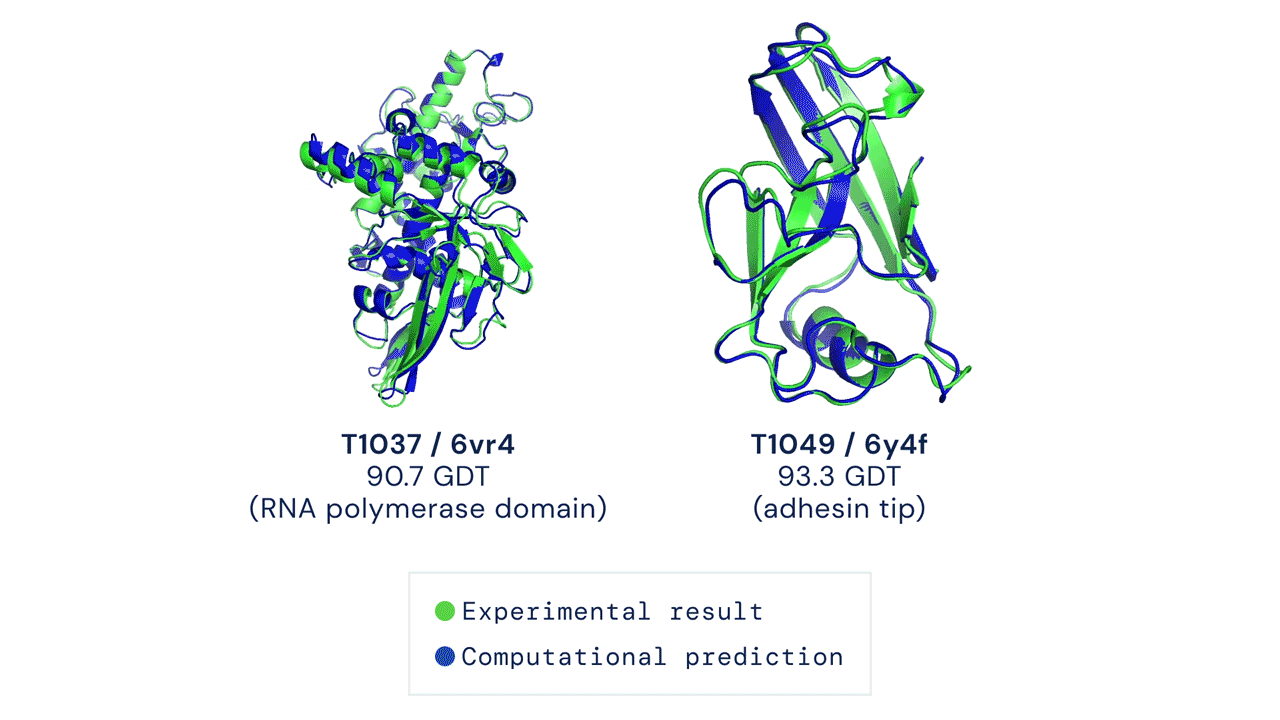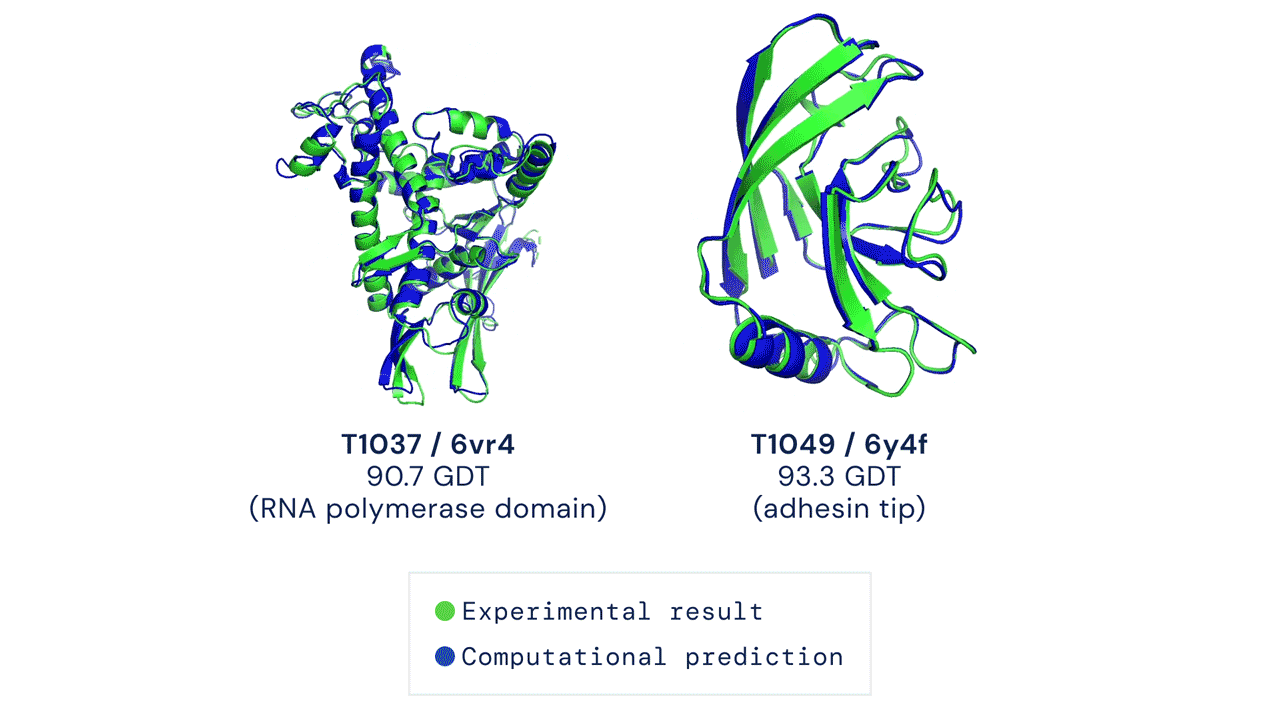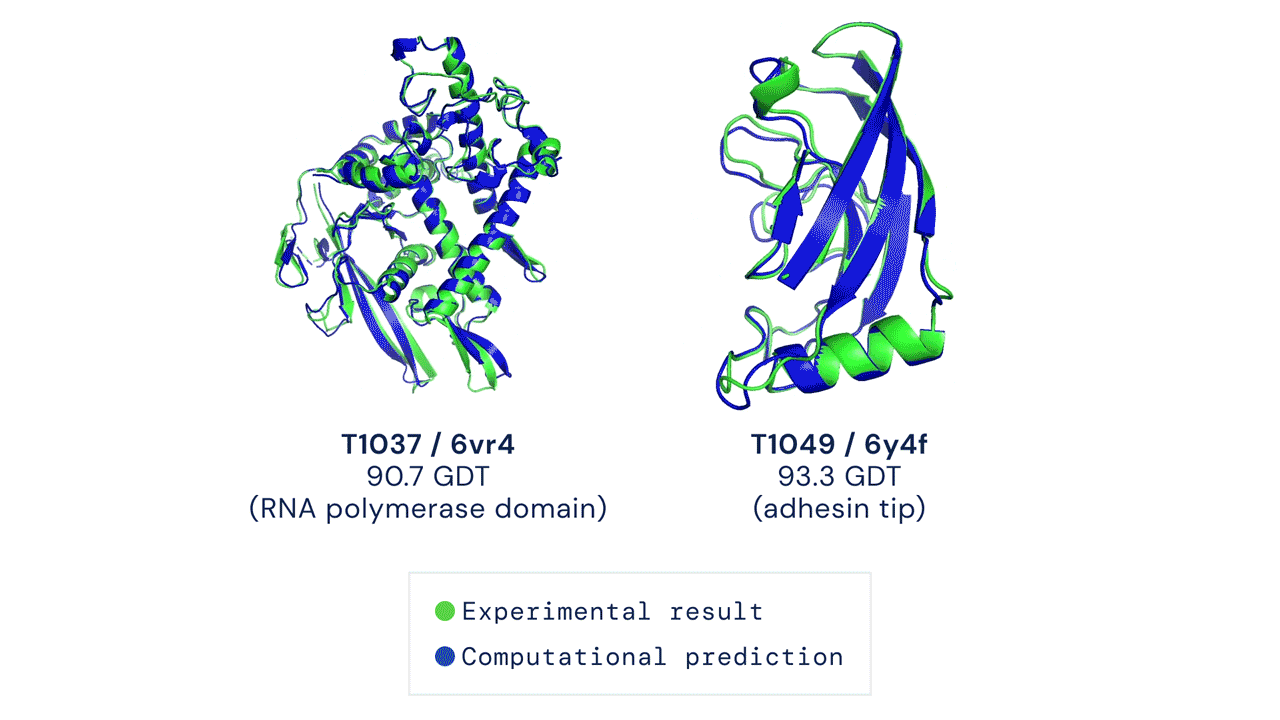
Áttörést hoz a biológiába a minden eddiginél pontosabb fehérjekutató algoritmus, az AlphaFold2
A Google-féle DeepMind legújabb AI-modellje az aminosavak sorrendjéből egész pontosan megfejti a fehérjék háromdimenziós térszerkezetét. A mesterséges intelligencia forradalmasíthatja a gyógyszerkutatást: van olyan rákkutató cég, ahol az AlphaFold2 a korábbi egy hónapról néhány órára csökkentette a hatóanyag-jelölt fehérjék megtalálását.

A mesterséges intelligencia gőzerővel keresi a vakcinát a koronavírus ellen
Az okos algoritmusok hónapokkal képesek csökkenteni a vakcinafejlesztéshez szükséges időt, és ez kulcsfontosságú a járvány elleni versenyfutásban. Persze az AI sem mindenható, a koronavírus-vakcina embereken történő tesztelését például egyáltalán nem válthatja ki.
