Magyar kutatók megtalálták a negatív élmények feldolgozásában kulcsszerepet játszó idegsejteket

Magyar neurobiológusok azonosították azokat az idegsejteket, amelyek kulcsszerepet játszanak abban, hogy az emlősök képesek legyenek tanulni az őket ért negatív élményekből – és közben arra jutottak, hogy ez a tanulási folyamat sem működik figyelem nélkül.
A pénteken a Nature Communications folyóiratban közzétett kutatásban Hangya Balázs, a HUN-REN Kísérleti Orvostudományi Kutatóintézet (KOKI) Rendszer-Neurobiológia Kutatócsoportjának vezetője és kollégái a bazális előagynak nevezett, evolúciósan ősi agyterületet vizsgálták. Ennek fő jelentőségét az idegtudományban az adja, hogy egyik fő sejttípusa, a kolinerg sejtek az Alzheimer-kórban, valamint a természetes öregedési folyamat során is jelentős számban halnak el. Az agyterület elülső részén a mediális szeptum helyezkedik el, amivel a neurobiológusok két, a Qubiten korábban bemutatott munkájukban is foglalkoztak.
2022-ben megállapították, hogy a mediális szeptum egyes sejtjei az összehangolódó ingaórákhoz hasonlóan a Huygens-szinkronizáció révén hozzák létre az epizodikus emléknyomok megformálásában és tárolásában résztvevő hippokampusz théta agyhullámait. Tavaly pedig azt tárták fel, hogy az agyterület hasonló sejtjei fontos szerepet játszanak a hippokampusz egyik, a thétánál gyorsabb agyhullámának, az emlékek tárolásához és előhívásához lényeges gamma oszcillációnak a vezérlésében.

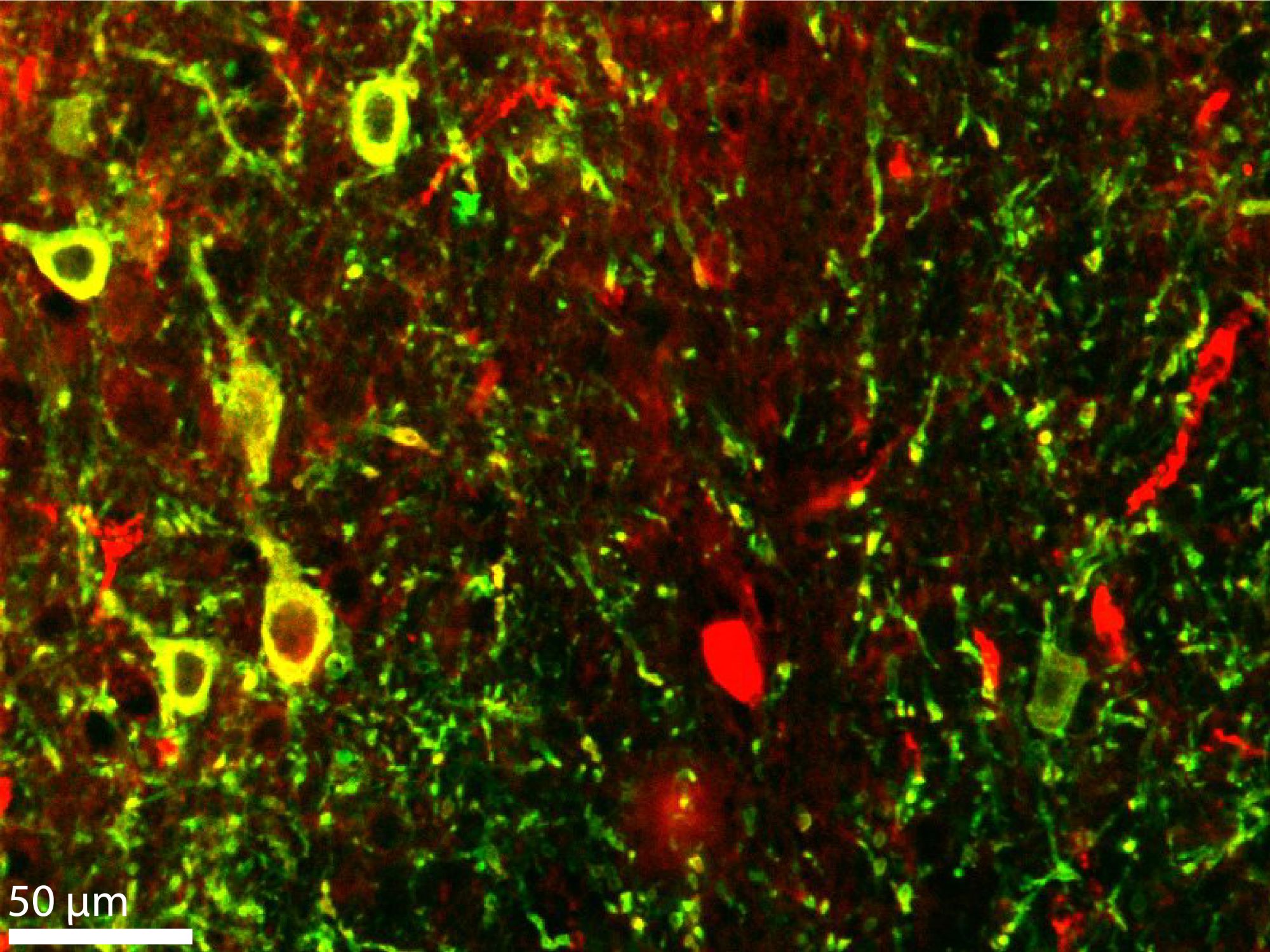
A vizsgált aktivitásért mindkét esetben ugyanahhoz az altípushoz tartozó, úgynevezett parvalbumin-pozitív GABAerg sejtek feleltek. A GABAerg sejtek az agy fő gátlósejttípusát adják, a bazális előagyban szintén megtalálható glutamáterg sejtek a fő serkentősejt-típusát, a már említett kolinerg sejtek pedig ezeknél egzotikusabbak, és különböző funkciókra képesek – magyarázta Hangya. A korábbiakkal ellentétben a parvalbuminnak nevezett, kalcium-jelátvitelben résztvevő fehérjét kifejező GABAerg sejteket (BFPVNs) nem a mediális szeptumban, hanem a bazális előagy egy hátulsó régiójában, a Broca-féle diagonális kötegben vizsgálták.
Hangya a bazális előagyat egy komplex rendszernek nevezte, amiről sokáig csak foghíjas képünk volt. A 2016-ban a neurobiológus által elnyert Lendület pályázat segítségével ezért hozzáláttak ezeknek a hiányosságoknak a betöméséhez, ami mára lehetővé teszi, hogy a bazális előagyat más, például a tanulás vagy a figyelem szabályozásában szerepet játszó rendszerek kontextusában tudják vizsgálni. Az agyterület parvalbuminos sejtjeiről már régóta tudni lehet, hogy axonjaikkal távoli agyterületekre vetítenek, vagyis a bazális előagytól nagyobb távolságra található területek idegsejtjeinek is képesek jeleket küldeni – és ez az, ami a kutatóknak különösen érdekessé tette őket.
A vezető elmélet a parvalbuminos GABAerg sejtekről sokáig az volt, hogy ébresztő funkciójuk van, amit Hangya szerint nem úgy kell elképzelni, hogy hirtelen képesek aktiválni az egész agykérget, hanem inkább arról van szó, hogy különböző időskálán – az egészen lassútól az egészen gyorsig – tudják modulálni a kérgi részeknek az aktivitását. Arról, hogy milyen szerepet játszanak ezek a sejtek betegségekben, egyelőre keveset tudunk, de a neurobiológus szerint az utóbbi években már kijött néhány tanulmány, amely arra utal, hogy az Alzheimer-kórban és az öregedés során nemcsak a kolinerg, hanem a GABAerg sejtek száma is csökken a bazális előagyban.
Mit jelent a negatív élmény az agykutatásban?
Az Alzheimer-kapcsolat miatt korábban mindig a kolinerg sejtek funkciói és pusztulásuk okai voltak az érdekesek – mondta Hegedüs Panna, a tanulmány megosztott első szerzője –, miközben GABAerg sejtekből ötször annyi található a bazális előagyban. Amikor ezt összerakták azzal, hogy a sejtek távoli célterületekre is vetítenek, adta magát a kérdés, hogy hozzájárulnak-e valamilyen módon a tanulási folyamatokhoz – jelen esetben a negatív ingerek feldolgozásához. Mielőtt megértenénk, hogyan adtak erre választ a kutatók, azt kell megnéznünk, hogy a „negatív élmények” emberi koncepcióját, ami elég széles skálán mozoghat, hogyan fordítják le konkrét idegtudományi kísérletekre.
Hangya szerint az a lényeges, hogy egy negatív behatás (averzív inger) elkerülő magatartást vált ki, vagyis az állatok, ha tehetik, nem akarják azt átélni. A kísérletekben az averzív inger vagy „büntetés” szerepét az egerek arcát érő levegőbefújás játszotta, amit ők nem egy kellemes nyári szellőként éltek meg. Ezt azzal igazolták, hogy amikor az állatok választhattak, hogy szellővel, vagy szellő nélkül kapjanak jutalmat, következetesen az utóbbira adták a voksukat, vagyis inkább elkerülték azt. A levegőbefújás mellett más averzív ingerek is alkalmazhatók, ilyen például a ragadozó jelenlétére utaló „rókaszag”, amit a rókák vizeletében található egyik összetevő elhelyezése biztosít, aminek hatására az egerek erősen elkerülik az adott területet.
A valóságban ha egy állat egy ilyen negatív ingerrel találkozik, az már az első alkalommal végzetes lehet, vagyis Hegedüs szerint ezeknek a jeleknek az idegrendszeri feldolgozásának nagyon hatékonynak és mélyen gyökerezőnek kell lennie. Hangya szerint ugyanakkor egy inger sokféleképpen lehet averzív: van, amelyik azonnali fenyegetés az állatnak, mint például a „rókaszag”, és van olyan, ami inkább kellemetlen, mint a kísérleteikben alkalmazott légbefújás, amely hosszú távon kiszáríthatja az állat szemeit. Az emiatt széles skálán elhelyezhető averzív ingerekben így az a közös, hogy érdemes őket elkerülni, hasonlóan azokhoz a dolgokhoz, amelyek az állatnak fájdalmat okoznak.
Az első nagy felfedezés: másként viselkednek a parvalbuminos és a kolinerg sejtek
A kutatók első, megerősítéses tanulási kísérleteiben pavlovi kondicionálást használtak, vagyis egy, az egereknek alapvetően semleges hangot kapcsoltak össze pozitív vagy negatív megerősítéssel, miközben mérték az állatok Broca-féle diagonális kötegében a parvalbuminos és a kolinerg sejtek aktivitását. A pavlovi kondicionálós kísérletekben volt egy csavar is: a hang nem 100 százalékban jelezte a jutalmat vagy a büntetést, hanem csak bizonyos valószínűséggel, így az esetek egy részében az állat meglepetésszerűen kapott jutalmat vagy büntetést – amivel Hegedüs szerint azt is meg tudták nézni, hogy a váratlan események miként képződnek le az idegsejtek aktivitásán.
A kísérletekből az derült ki, hogy a parvalbuminos GABAerg sejtek elsősorban a negatív megerősítésre, vagyis a büntetésre válaszoltak, ellentétben a jutalomra és büntetésre, vagy azok hangjelzésére egyaránt reagáló kolinerg sejtekkel. „Ezt nem tudtuk előre” – mondta Hangya, és ez volt az az első felfedezés, amire aztán a többi kísérletet építették, mert ez felvetette, hogy a parvalbuminos GABAerg sejtek fontosak lehetnek abban, hogy az állatok az averzív ingerekből tanuljanak.
A második nagy felfedezés: a sejtek gátlása a tanulást is megakadályozza
Ezután azt nézték meg, hogy mi történik, ha pont akkor gátolják ezeket a parvalbuminos sejteket, amikor az állatokat megfújják levegővel. Ehhez az optogenetikának nevezett módszert választották, amely a sejtekbe juttatott fényérzékeny fehérjékkel és a fénynek az adott agyterületre száloptikán keresztül történő bejuttatásával lehetővé teszi, hogy egy adott területen sejtek aktivitását szabályozzák.
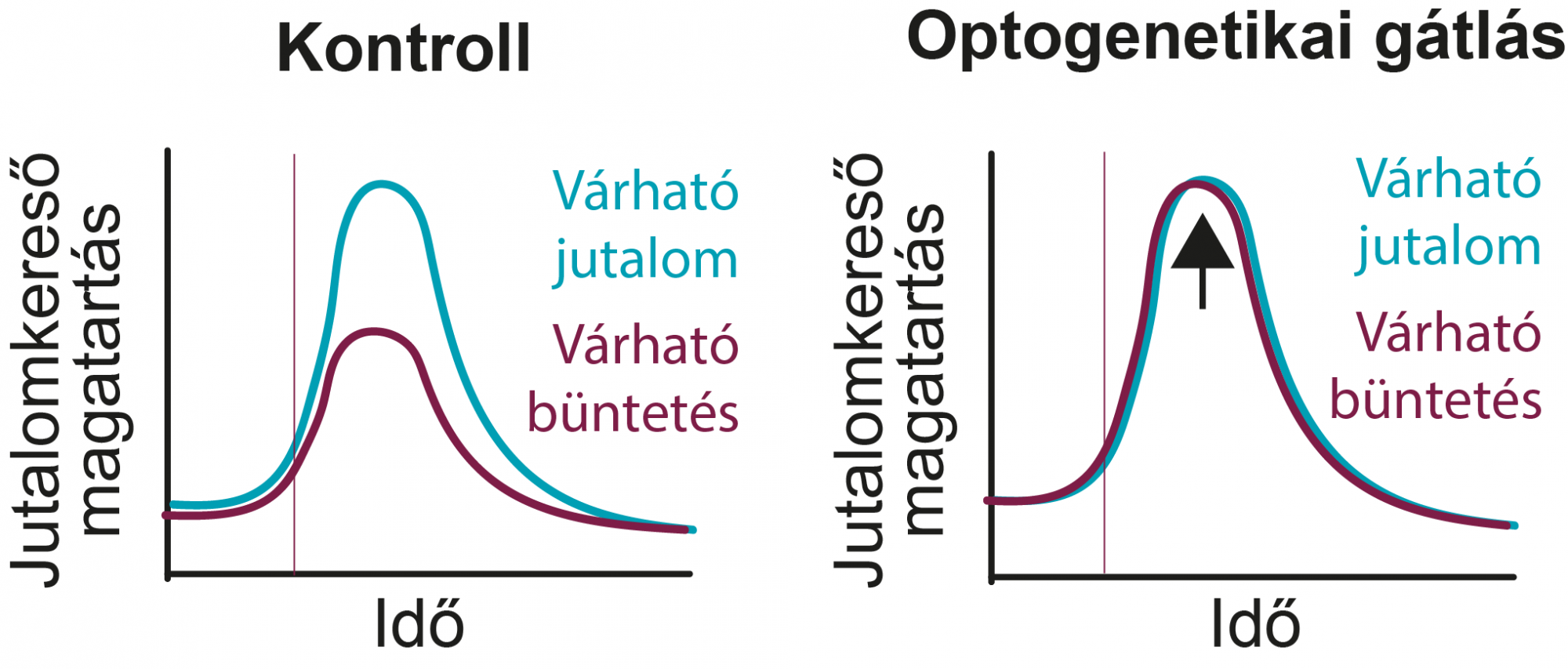
A kísérletek során, amelyek elvégzésében Hegedüs mellett Lyakhova Victoria is fontos szerepet játszott, a kutatók azt tapasztalták, hogy a gátolt parvalbuminos sejtekkel az állatok nem tudtak a levegőbefújást jelző hanghoz „negatív élményt” társítani. Az egerek normál esetben a negatív történést előrejelző hang után kevésbé számítanak jutalomra és mutatnak jutalomkereső magatartást, magyarázta Hangya, ami konkrétan azt jelenti, hogy nem nyalogatják annyira a folyadékjutalmat szállító csövet – amikor viszont gátolták a sejteket, nem tapasztalták a jutalomkeresés gyengülését.
Az optogenetikai gátlásos kísérletek Hegedüs szerint két kihívást is felvetnek. Egyrészt ha ok-okozati összefüggést akarnak velük bizonyítani, akkor azoknak precízen kontrolláltnak kell lenniük, vagyis ügyelniük kell arra, hogy egyetlen változón kívül – ami a kísérletet lehetővé tevő ioncsatorna bejuttatása – a gátolt parvalbuminos egereknél és a kontrollcsoportba tartozó állatoknál is minden ugyanúgy történjen.
Egy másik nehézség, hogy a bazális előagy az egereknél egy mélyen fekvő terület, így kihívást jelent az optogenetikai gátláshoz szükséges ioncsatornát bejuttató vírusvektor precíz adagolása. Ugyanakkor pont ezen múlik az, hogy mekkora területen befolyásolják a sejtek aktivitását – csak ott, ahol kell, vagyis a Broca-féle diagonális köteg horizontális szárában, vagy más területeken is. Azt, hogy ez sikerült-e, utólag, a szövettani feldolgozásnál tudják ellenőrizni, mert a vírusvektorokat Hangya elmondása szerint eleve úgy tervezik, hogy az ioncsatorna mellett egy fluoreszcens fehérjét is kódoljanak, amitől kék fény alatt zölden világít a befolyásolt terület.
De hogyan egyeztethető össze az, hogy a parvalbuminos sejtek egyfajta ébresztőrendszerként funkcionálnak azzal, hogy amikor a kutatók legátolták őket, akkor egy tanulási folyamatot akadályoztak meg? „Azt gondoljuk, hogy esetleg ez a parvalbumin-GABAerg rendszer úgy működik, hogy specifikusan ébreszt bizonyos agyterületeket, és ott létrehoz egy lokális figyelmet, ami szükséges a tanuláshoz” – mondta Hangya, aki szerint ez jól beleillik az „attention for learning” koncepcióba, amely szerint a tanulásnak feltétele egyfajta figyelem is.
A kutatóknak közben arról is meg kellett győződniük, hogy a parvalbuminos sejtek viselkedése tényleg csak rájuk jellemző, és más GABAerg sejtekre, például a bazális előagy szomatosztatin-pozitív GABAerg sejtejeire (BFSOMN) nem. Utóbbiakról Hangya szerint lehetett tudni, hogy főleg helyi kapcsolatokkal rendelkeznek, és távoli vetítéseik valószínűleg nincsenek, valamint azt is, hogy a parvalbuminos sejtekhez képest nem ébresztő, hanem altató funkciójuk van. Ezekkel összhangban azt találták, hogy a szomatosztatinos sejtek válaszai nagyon eltértek a parvalbuminosokétól, és a kolinerg sejtekére emlékeztettek – ami meglepte a kutatókat, akik azt feltételezték, hogy a szomatosztatinos és kolinerg sejtek fordítottan működnek.
Hangya szerint egy lehetséges magyarázat, hogy amit itt láttak, az a szomatosztatin rendszer negatív visszacsatolása volt a kolinerg rendszeren – így nem lenne meglepő, hogy a sejtek hasonló aktivitást mutatnak, mert amikor a kolinerg sejtek aktiválják a szomatosztatinos sejteket, akkor annak hatására ők gátolják a kolinerg sejteket. Ezt Hangya szerint úgy lehetne bizonyítani, hogy egyes sejtek elektromos aktivitását mérik, amivel teljesen pontosan meg tudnák határozni az események időzítését – a kutató a hipotézis értelmében arra számítana, hogy a szomatosztatin sejtek aktivitása késik a kolinerg sejtekéhez képest.
Messzire elérnek a parvalbuminos sejtek jelei
A neurobiológusok ezután arra keresték a választ Nyiri Gábor kutatócsoportjával (HUN-REN KOKI) együttműködésben, hogy milyen agyterületek és pályák hatnak a bazális előagy hátulsó részének parvalbuminos sejtjeire. Kiderült, hogy több ilyen is van: a bazális előagy elülső részének szeptális magjai, az agytörzs Raphe-magjai, valamint az averzív ingerek kódolásában fontos laterális hipotalamusz – Hegedüs az utóbbi kettő jelentőségét emelte ki. Hangya szerint most úgy néz ki, hogy a parvalbuminos sejteknek a Raphe-magok serkentő sejtjei adhatják az averzív ingert a közvetítő bemenet jelentős részét, miközben a laterális hipotalamuszból érkező pálya valószínűleg inkább gátló hatású lehet – de ezt majd jövőbeli kísérleteknek kell igazolni.
A bemeneteik mellett a kutatók arra is kíváncsiak voltak, hogy mely területekre vetítenek a parvalbuminos sejtek axonjai, és ott milyen aktivitást mutatnak. Ezidáig ugyanis csak a Broca-féle kötegben vizsgálták a sejteket, és az ott megfigyelt aktivitás Hegedüs szerint nem kell, hogy automatikusan tükröződjön a sejtek célterületein. Ehhez egy száloptikás fotometriának nevezett módszert vetettek be azokon az agyterületeken, ahova a legtöbb parvalbuminos rost vetült, amivel egy kalciumkoncentrációra érzékeny fluoreszcens molekula segítségével meg tudták mérni az idegsejtek aktivitását, lényegében fotonok számlálásán keresztül.
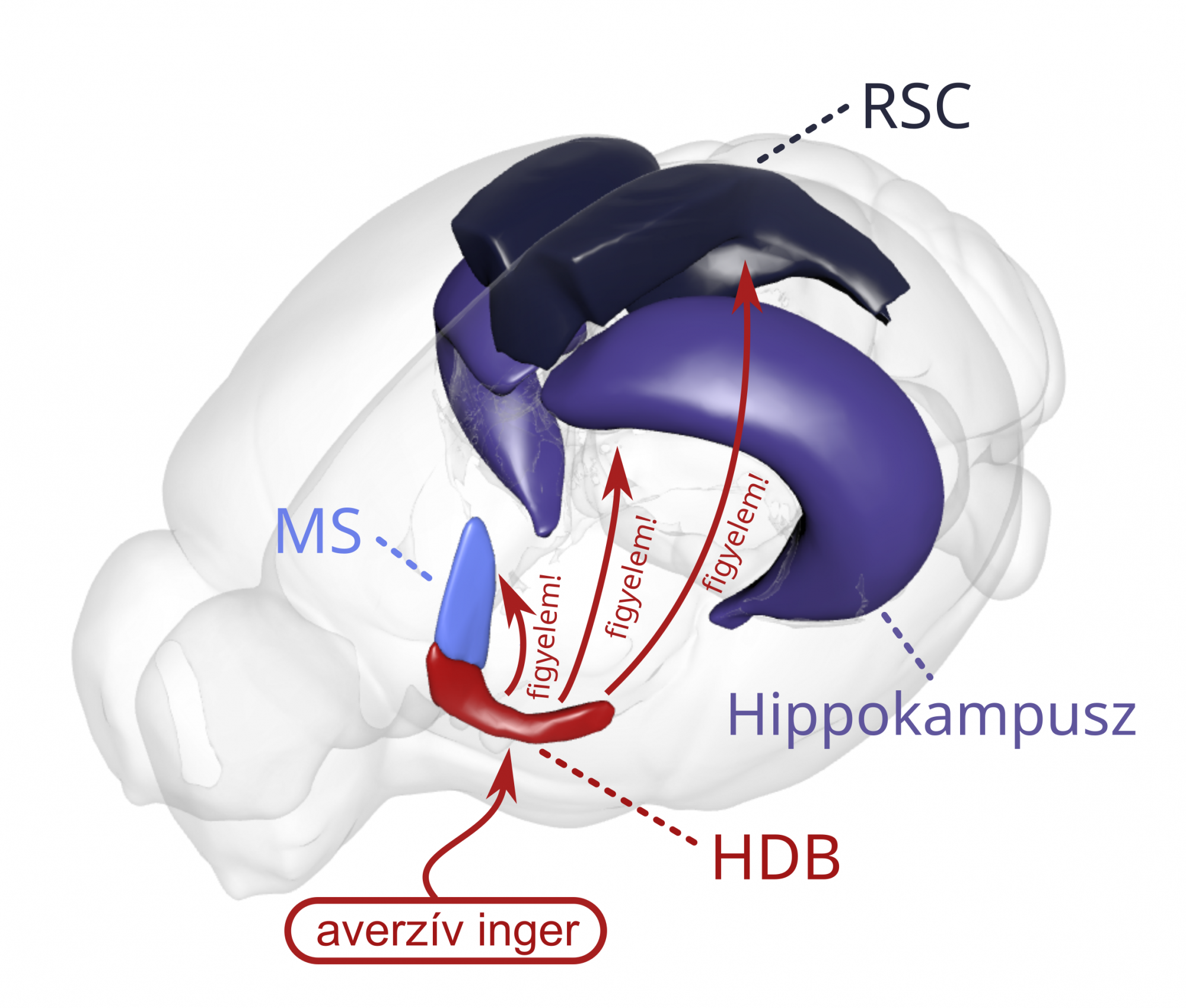
Ezen agyterületek közé tartozik a limbikus rendszerben résztvevő mediális szeptum és az epizodikus memóriában fontos hippokampusz, valamint az agykéreg egy kevésbé közismert területe, a retrosplenialis kéreg, amely a kontextuális tanulásban játszik szerepet. Hangya szerint ez a kérgi terület nagyon izgalmas, mert többfajta érzékszervből kap információt, vagyis nem köthető például csak a látáshoz vagy halláshoz. Emiatt multimodális asszociációs kéregnek nevezik, ami különböző dolgokat integrál – például navigáció során az egocentrikus (a dolgok helye hozzánk képest) és allocentrikus (térképszerű elképzelés a helyszínről) információkat.
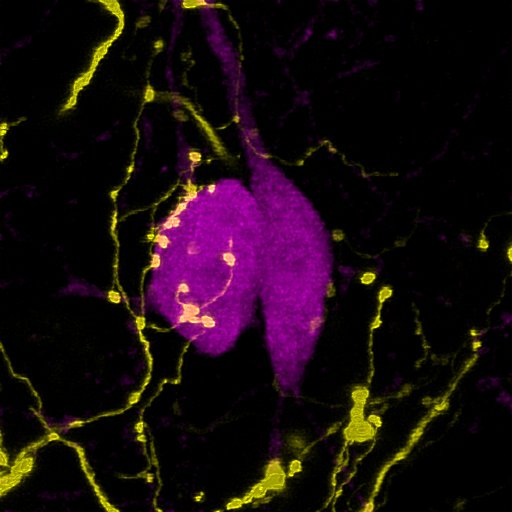
A fotometriás kísérlet arra világított rá, mondta Hegedüs, hogy ezeken az agyterületeken ugyanúgy megjelent a korábban a Broca-féle diagonális kötegben mért aktivitási mintázat, vagyis az averzív ingerekre adott válasz továbbítódik a limbikus rendszer felé. Hangya szerint részben már korábban is ismertek voltak a parvalbuminos sejtek célterületei, de „így, hogy egyben láttuk az egészet, nem volt nehéz észrevenni, hogy rengeteg limbikus területre vetítenek” – mondta.
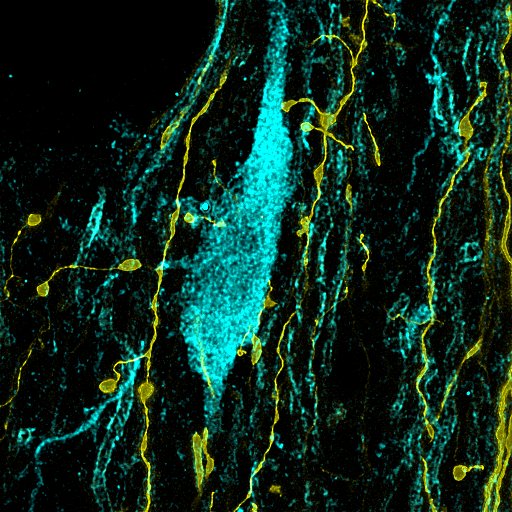
Az is kiderült, hogy az averzív inger kódolása nem csak egy-egy célterületre jut el, hanem az összesen megjelenik, Hangya szerint egyfajta szélessávú adásként. Később petricsészékben agyszeleteken végzett in vitro kísérletekkel azt is felderítették, hogy miként hatnak a parvalbuminos sejtek más agyterületek sejtjeire. Ezekből a Schlingloff Dániel által végzett kísérletekből arra jöttek rá, hogy bizony vannak területenként eltérések, ami felveti a kérdést, hogy melyik agyterület valójában mihez kezd a parvalbuminos sejtek által átadott információval.
Miként nézhet ki ez az emberi agyban?
A kutatók által vizsgált bazális előagy, valamint a parvalbuminos sejtek célterületét adó limbikus rendszer mai tudásunk szerint emlősökben viszonylag hasonlóan működik. Arra viszont egyelőre nem lehet biztos választ adni, hogy miként funkcionálnak ezek a sejtek emberekben, és Hangya szerint valójában ez adja az állatkísérletek létjogosultságát. A neurobiológus elmondta, az a céljuk, hogy minél jobban kombinálni tudják az egérkísérletekből és humán vizsgálatokból érkező információkat, ahol előbbi a mögöttes mechanizmusok megértését szolgálja, utóbbi pedig azok közvetlen relevanciáját világítja meg.
Ezt közelebb hozhatja két mostanában zajló fejlesztés is. Hangya szerint az egyik a funkcionális mágneses rezonanciás képalkotók (fMRI) egyre javuló térbeli felbontása, ami lehetővé teszi kisebb, a bazális előagyhoz hasonló területek vizsgálatát. Az fMRI a véráramlás változását képezi le, magyarázta, ami egy közvetett jele a sejtaktivitásnak, vagyis önmagában még nem vezet el a sejttípusok azonosításához. Itt jön a képbe egy másik előrelépés: kémiai elektródák beültetésével mérni lehet betegeknél a neurotranszmitter-koncentrációkat, ami a jövőben közelebb vihet például a dopaminerg rendszer aktivitásának megértéséhez.