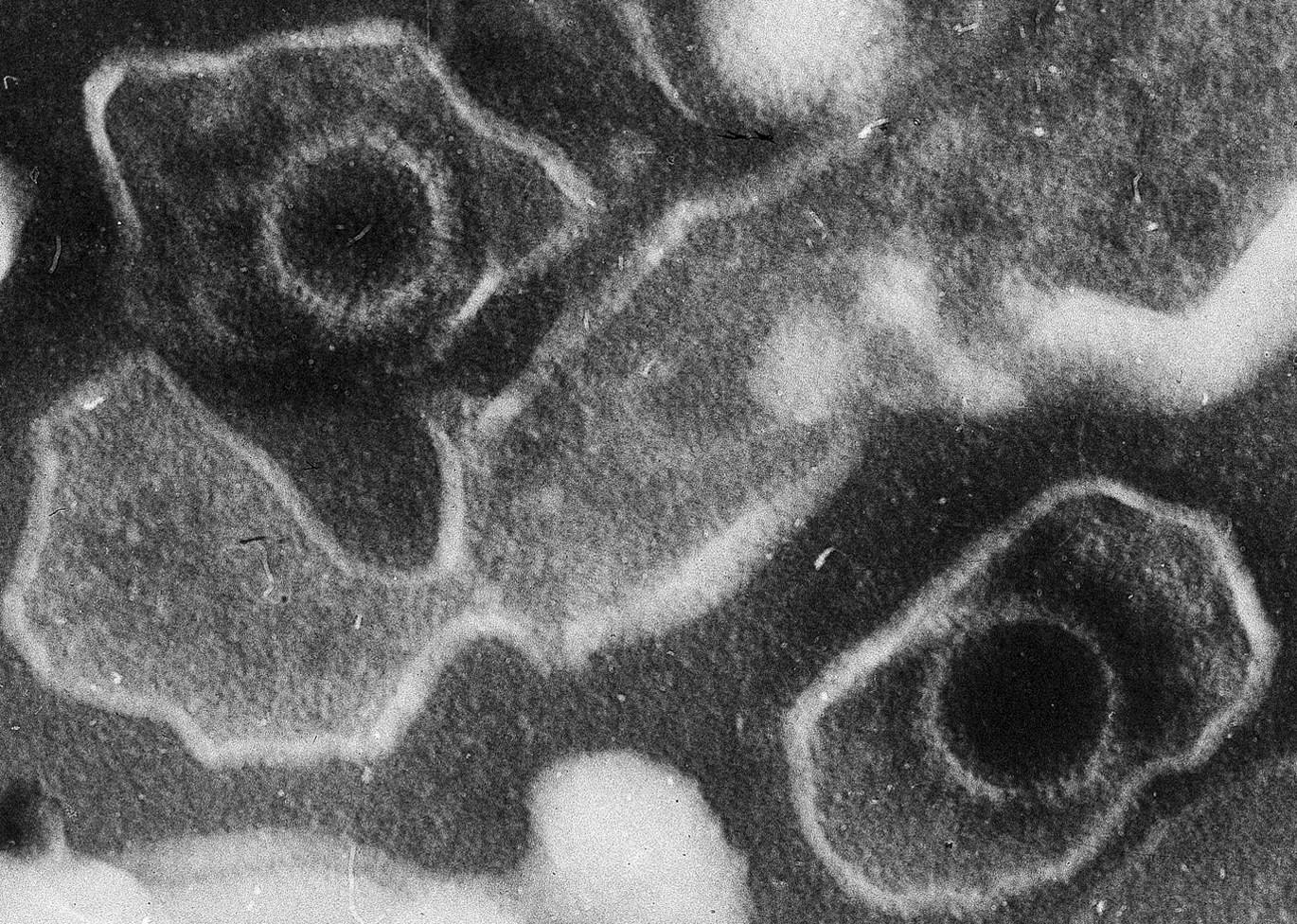
Három dimenzióban kell gondolkodnunk, ha meg akarjuk érteni a DNS működését

Az emberi genomot két méter hosszú DNS alkotja, és ennek parányi területen kell elférnie. Bár az már több mint száz éve ismert, hogy az örökítőanyag kromoszómákba rendeződik, azt a térbeli szerkezetet, amely a genomot sejtmagba csomagolja, és annak működését csak az elmúlt években kezdjük igazán megérteni.
Az áttörést olyan új vizsgálati megoldásoknak köszönhetően sikerült elérni, mint a szuperfelbontású mikroszkópok vagy az újgenerációs genomszekvenáláson alapuló technikák. Ezek betekintést adnak a kutatóknak a DNS és a hozzá kötődő fehérjék által létrehozott kromatinba, vagyis a genom háromdimenziós szerkezetébe. Ennek zavarai szerepet játszhatnak daganatok és neurológiai betegségek kialakításában, a vírusos fertőzések pedig jelentősen átformálhatják a sejt normál működéshez szükséges szerkezetét.
Több milliárd éve élnek a Földön olyan mikroorganizmusok, köztük az élővilág egyik nagy csoportját alkotó archeák, amelyek DNS-üket fehérjék által alkotott struktúrák köré csomagolják. A legfrissebb kutatások alapján az archeáknak ezekre a szerkezetekre elsősorban a magas hőmérsékletű környezetek, például hőforrások tolerálásához van szükségük, vagyis a kromatin eredetileg ennek érdekében alakulhatott ki.
Az állatokat, növényeket, gombákat és számtalan egysejtűt magába foglaló eukarióták az archeák egy csoportjából alakultak ki, és genomjuk működése elképzelhetetlen kromatin nélkül. Az eukarióták korai evolúciójuk során a meglévő alapokra egy bonyolult gépezetet építettek, amely az archeákéhoz képest hatalmas genomjaik kompaktabbá csomagolásában, a gének kifejeződésének szabályozásában és a DNS működéséhez szükséges más kritikus funkciókban játszik szerepet.
Hogyan épül fel a kromatin?
Az eukarióta sejtekben, így sajátjainkban is 146-147 bázispár hosszúságú DNS tekeredik a nukleoszómáknak nevezett szerkezetek köré, amiket nyolc hiszton fehérje épít fel. A 10 nanométeres nukleoszómák, amelyeket rövid DNS választ el, átlagosan 200 bázispáronként követik egymást. A hiszton fehérjéken található egy régió, amelyet enzimek képesek kémiailag módosítani – ezek a folyamatok leggyakrabban négy típusba (acetiláció, metiláció, foszforiláció és ubiquitináció) sorolhatók.
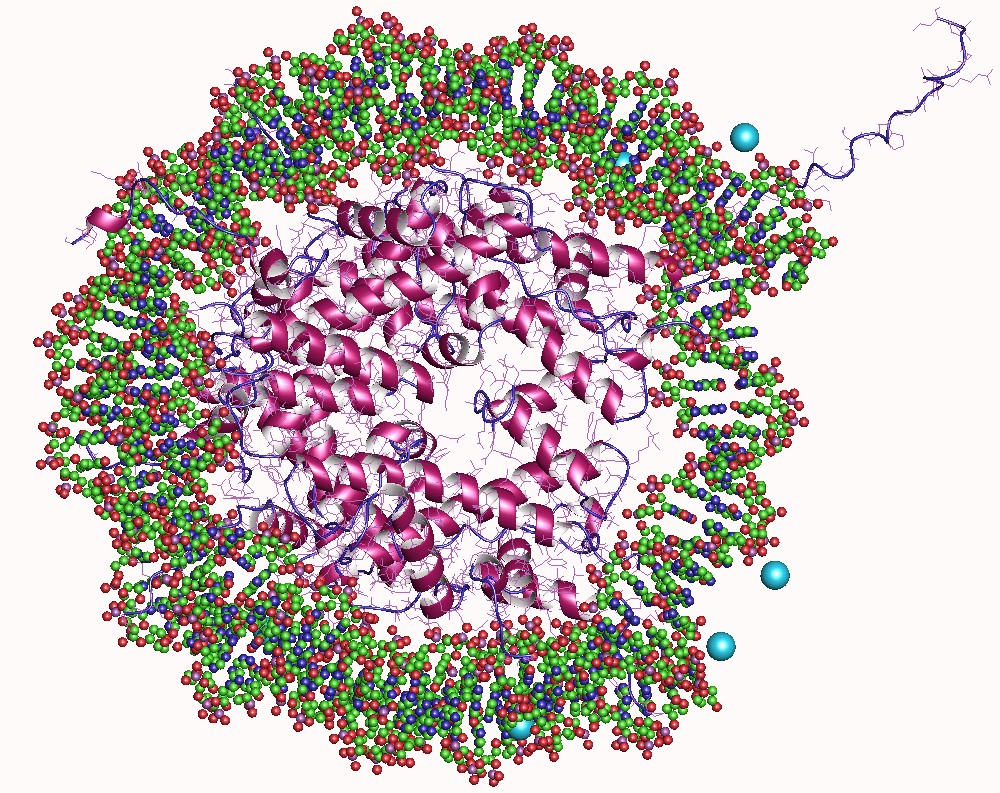
Ezek a módosítások képesek befolyásolni a hisztonok DNS-hez kötődését, ami ezáltal gének kifejeződését és más genetikai folyamatokat szabályoz, és együttesen alkotja az úgynevezett „hiszton kódot”. A hiszton egyes módosításai meghatározzák a genom aktív vagy inaktív régióit, és ezért a kromatin nagyobb skálájú szerkezetére is hatással vannak – olvasható egy, a Nature Methodsben megjelent 2020-as tanulmányban.
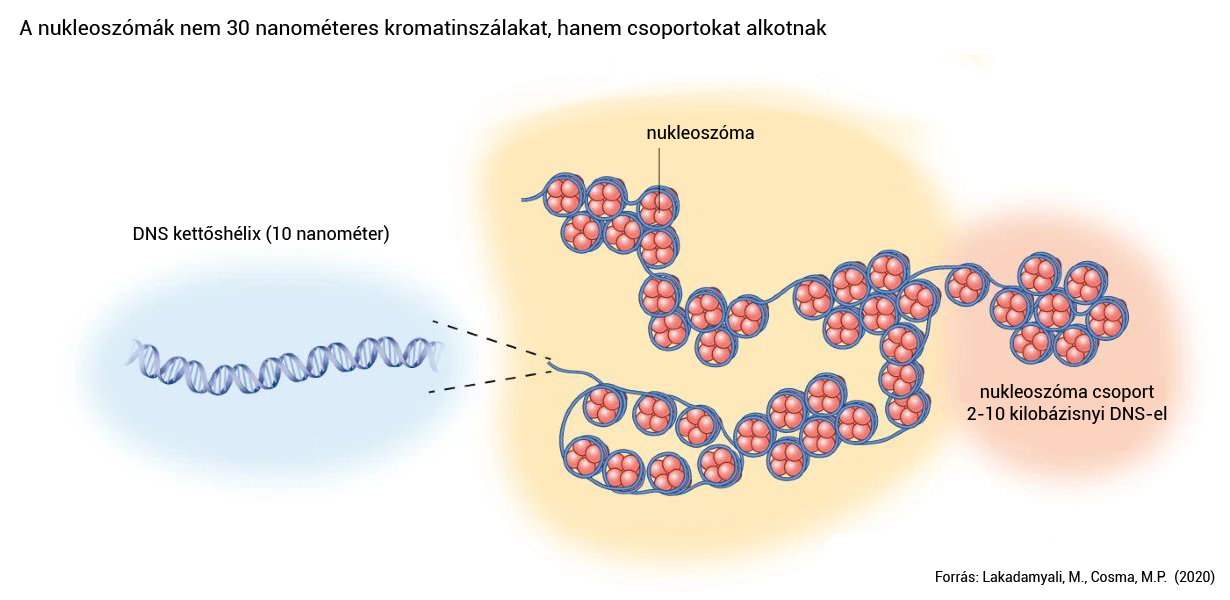
Az is világossá vált az elmúlt néhány évben, hogy a kromatin egy bizonyos mérettartományban nagyon nem úgy épül fel, ahogy azt a molekuláris biológiai tankönyvek leírják. Az egymás utáni nukleoszómák ugyanis kísérletek alapján egyszerűen nem hoznak létre egy, a modellekben szereplő 30 nanométeres kromatinszálat. Ehelyett a nukleoszómák szuperfelbontású mikroszkópos vizsgálatok alapján csoportokat (nucleosome clutches) alkotnak, amelyekben egyenként néhány ezer bázispárnyi DNS tömörül össze.
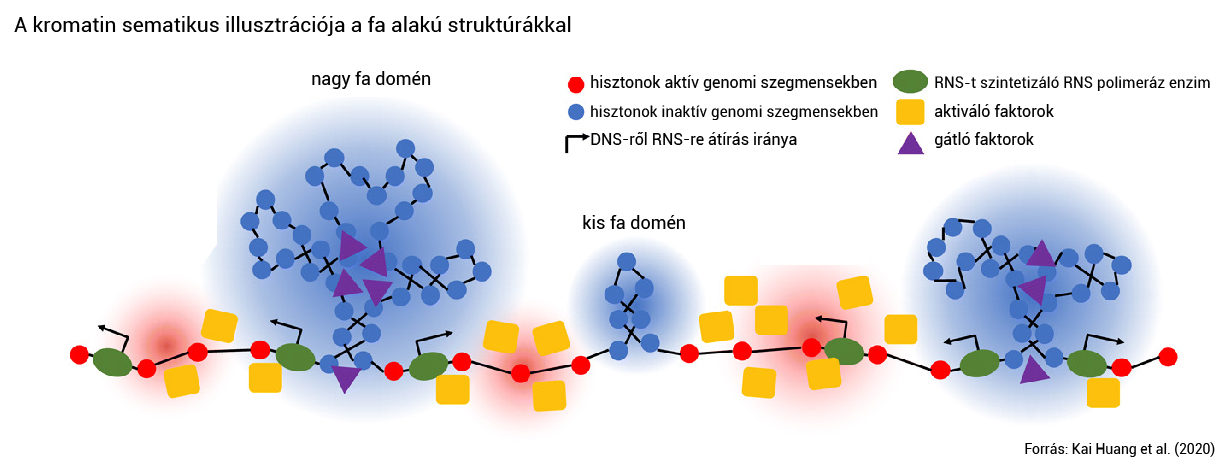
Az amerikai Northwestern Egyetem kutatóinak 2020-ban közölt kutatása megerősíti a nukleoszóma-csoportok létét, és azt állítja, hogy ezek nagyobb skálán faalakú struktúrákba rendeződhetnek biológiai funkciójuk teljesítéséhez. Bár ennek igazolásához további kutatások szükségesek, lehetséges, hogy ezek a nagy, néhány tízezer bázispár hosszú régiók alkotnak két fontos kromatinstruktúrát. Ezek a kromatinhurkok (chromatin loops), valamint a topológiailag asszociált domének (TAD, topologically associated domain).
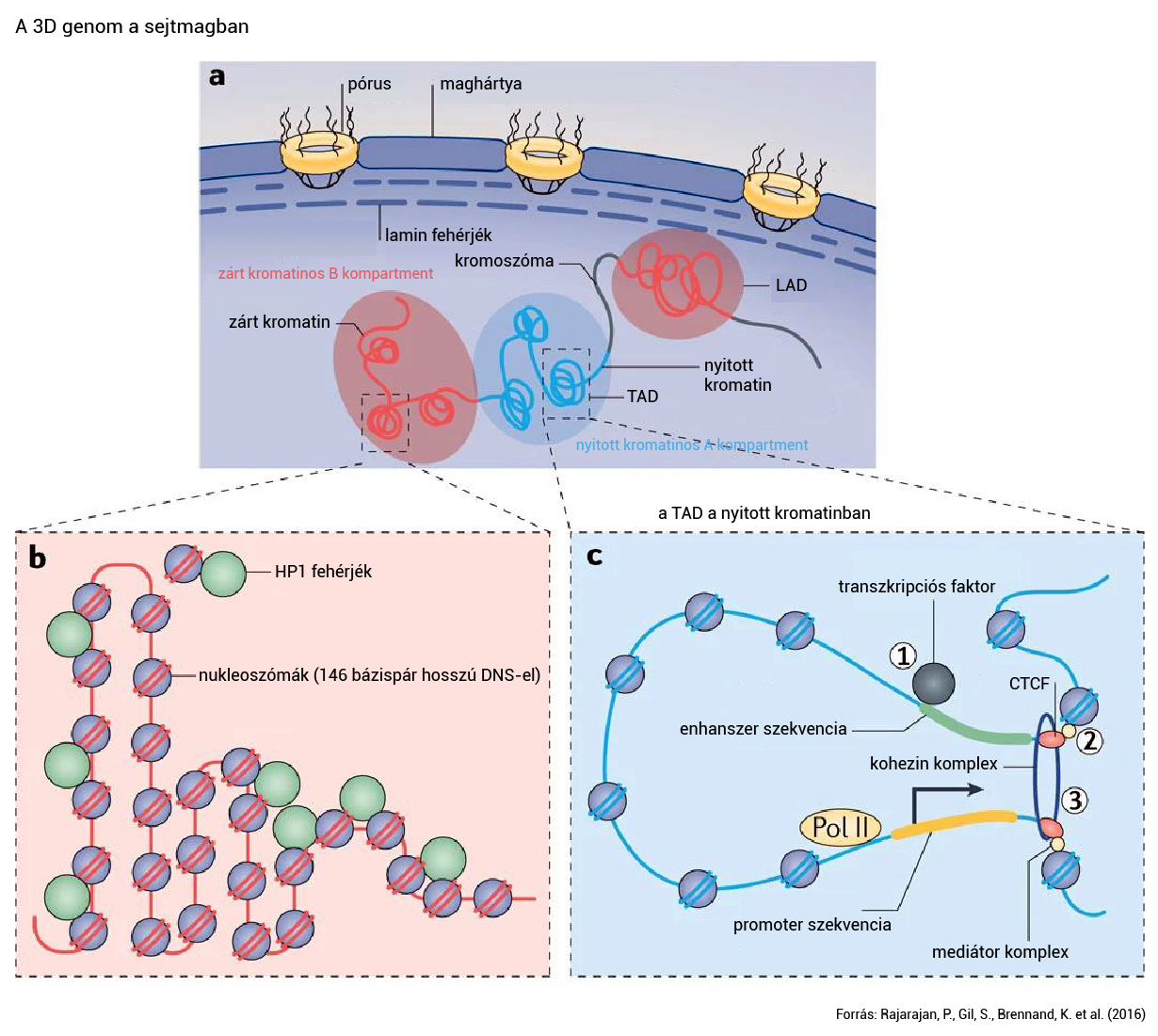
A kromatinhurkok lényegében két fontos szereplőt kötnek össze ahhoz, hogy a gének ki tudjanak fejeződni. Az egyik az egymástól nagyobb távolságra elhelyezkedő szabályozó elemek, például enhanszerek, amelyek képesek fokozni egy gén DNS-ből RNS-é való átíródásának esélyét, legalábbis ha csatlakoznak hozzájuk transzkripciós faktoroknak nevezett fehérjék. A másik pedig a gén átíródásához nélkülözhetetlen promoter.
A TAD-ok olyan genomi régiók, amelyek belsejében a DNS-szakaszok inkább egymással lépnek gyakrabban kapcsolatba, mint más régiókban található DNS-ekkel. A legtöbb, enhanszereket és promotereket összekötő kromatinhurok is a TAD-okon belül alakul ki egy 2016-os, a Nature Reviews Geneticsben megjelent összefoglaló szakcikk szerint. A TAD-ok hossza néhány százezertől néhány millió bázispárig terjedhet, és újabb eredmények szerint határvonalaik nem annyira élesek, mint azt korábban a kutatók feltételezték, és a szomszédos TAD-ok akár keveredhetnek is egymással.
Ha eggyel kisebb nagyításra lépünk, több TAD két eltérő típusú (A vagy B) kompartmentet hozhat létre, amelyek a genom térben elválasztott aktív, nyitott kromatinból (A kompartment) és inaktív, zárt kromatinból (B kompartment) álló régiói. Még eggyel magasabb szinten a kromatin egyedi kromoszóma-területekre oszlik, kromoszómánként egyre, és ezek ritkán keverednek egymással. Maga a sejtmag alakja is dinamikusan változik, amit a DNS csomagolódásának mértéke és a sejtváz határoz meg. A sejtmag alakjának szabályozása a kromoszómák struktúráját is képes megváltoztatni, és különböző kölcsönhatásokat is okozhat a genom egymástól távoli régiói között.
A Nature Methods-tanulmány szerzői szerint izgalmas időket élünk, amikor a szuperfelbontású mikroszkópok, valamint az új genomikai megközelítések régóta fennálló kérdésekre adnak választ. Az egyik ilyen kritikus fontosságú genomikai technika az újgenerációs szekvenáláson alapuló Hi-C térszerkezetvizsgálat, illetve annak változatai – ezeknek többek között a TAD-ok felfedezésében is nagy szerepük volt.
Ha elromlik a 3D genom, jönnek a betegségek
A 2010-es években indult 4D nucleome projekt az ember- és az egérgenom térbeli struktúrájának és annak időben dinamikus változásának feltárását célozta meg. A program keretében eddig 703 publikált tanulmány született, amelyek arról árulkodnak, hogyan vesz részt a 3D genom a génszabályozásban és más genomi funkciókban, és hogy ezt milyen innovatív technológiákkal lehet vizsgálni a jövőben.
Még januárban írtunk egy, a Nature-ben közölt kutatásról, amely szerint a biológiában elterjedt modellélőlény, a lúdfű genomjában a mutációk eloszlása nagyon nem véletlenszerű, és ennek 90 százalékát a genom 3D szerkezetét is befolyásoló epigenetikai tényezők okozzák, például a hiszton kód. Egy 2015-ben, a Nature Reviews Geneticsben megjelent összefoglaló szakcikk szerint a mutációs ráta változása befolyásolhatja a gének funkcióit normál, valamint daganatos sejtekben is. A kromatin és a mutációs ráta közti összefüggés pedig olyan enzimekre világít rá a genetikusok szerint, amelyek a kromatin állapotát egyes ráktípusokban szabályozzák.
A 3D genom strukturális variációinak szerepével foglalkozott Malte Spielmann és kutatócsoportja egy 2018-as kutatásban. Ezek olyan kromoszóma-átrendeződések, amelyek képesek megváltoztatni a géneket szabályozó elemek számát, és meg tudják zavarni a TAD-okat, ami betegségek kialakulásához vezethet. A kromoszóma-átrendeződések mellett betegségekhez köthető genetikai mutációk vizsgálata egy 2016-ban publikált szakcikk szerint lehetővé teheti a kölcsönhatási kapcsolatok elromlása miatt hibásan szabályozott gének megtalálását. Ez pedig segíthet felderíteni a betegségek molekuláris mechanizmusait, és megnyitni az utat a kezelésük előtt.
A 3D genom aktivitásfüggő változásai az idegrendszerben tanulással összefüggő DNS-ről RNS-re történő átírási folyamatokat irányítanak. Emellett úgy tűnik, hogy a 3D genom abban is részt vesz, hogy az idegrendszeri sejtekben a gének az aktuális agyi aktivitástól függően fejeződjenek ki – állítja egy, a Nature Reviews Neuroscience-ben 2016-ban megjelent tanulmány. A szakértők által idézett egyes kutatások arra mutatnak, hogy a kromatinhurkokban található, fehérjét nem kódoló DNS hozzájárul olyan kognitív zavarok vagy betegségek genetikai kockázataihoz, mint az autizmus spektrumzavar vagy a skizofrénia. A kutatók szerint a szintén kromatinhurkokban található, már említett enhanszerek olyan neurodegeneratív betegségekben is szerepet játszhatnak, mint az Alzheimer-kór.
Vírusos fertőzések és a 3D genom
Ezek után nem meglepő, hogy a 3D genomnak a vírusos fertőzések esetén is van szerepe, amit Liang Vejcseng és kollégái foglaltak össze 2022 augusztusában, a rangos Medical Journal of Virology folyóiratban megjelent szakcikkükben. A legtöbb eukariótát fertőző, DNS örökítőanyagú vírus képes a sejtmagba juttatni a genomját, de az még nem teljesen világos a kutatók szerint, hogy ezután mi történik a vírusgenom és a gazdasejt genomja között.
A vírus fehérjéi, mint írják, a gazdasejt szabályozófehérjéit utánozza, és így téríti el annak egész szabályozórendszerét, amivel át tudja alakítani a sejt kromatinszerkezetét. Az már eddig is ismert volt a szakemberek szerint, hogy miután egyes vírusok bejutnak a sejtbe, a sejtmagba kerülő vírusgenom jelentős hatást mérhet a gazdasejt genomjának térbeli szerkezetére, ami után specifikus vírusok esetén – leggyakrabban retrovírusoknál – a gazdasejt genomjába integrálódnak.
A májgyulladását okozó Hepatitis B DNS-vírus (HBV) képes genomját a sejtmagba juttatni, és egy speciális struktúrájú DNS-el a sejt gépezetét saját replikációjára áthangolni. A vírus továbbá meg tudja zavarni a genom 3D struktúráját, ami megváltoztatja a sejtben a gének kifejeződését. Hasonló a helyzet a herpeszvírusokhoz tartozó Epstein–Barr-vírus esetén is. Ez 15 ezer ponton áll kölcsönhatásban az emberi genommal, főként a nyitott kromatinos régiókban. A látens EBV-fertőzés reaktiválódása során azt figyelték meg korábbi vizsgálatokban, hogy a vírus genomunkkal történő kölcsönhatása a zárt kromatinos régiókból a nyílt kromatinosokba helyeződött át, vagyis úgy tűnik, hogy az EBV képes befolyásolni genomunk 3D szerkezetét.
Influenzavírusokkal 2018-ban végzett vizsgálatok pedig arra utalnak, hogy a vírus NS1 fehérjéje képes hatni a DNS-ről RNS-re zajló átíródás szabályozására, ami teljesen megváltoztatja a gazdasejt kromatinjának működését és kompaktságát.
A kutatók szerint a 3D genom betegségekkel időben összefüggő változásának vizsgálata segíthet még jobban megérteni, hogyan okozzák ezeket a vírusos fertőzések. Emellett azt a lehetőséget is biztosíthatják, hogy a változások biokémiai jelei feltáruljanak, és kutatók terápiás célpontokat keressenek a fertőzéses megbetegedések kezelésére.
Kapcsolódó cikkek a Qubiten:

Ha a Földön kívül akar túlélni az emberiség, nem úszhatja meg a génszerkesztést
A súlytalanság és a kozmikus sugárzás hatásait az emberi szervezetre csak az elmúlt években kezdték igazán feltérképezni, de egy kutató már az emberiség következő 500 évére írt menetrendet: eszerint a sci-fikből ellesett technológiák mellett arra is szükség lesz, hogy más élőlények génjeivel tömjük meg az emberi genomot.
A szintetikus biológia korában élünk, de a mesterséges élet létrehozása még mindig csak álom
Az elmúlt húsz év áttöréseinek köszönhetően mára lehetővé vált az élőlények, köztük az ember genomjának szerkesztése, de minden igyekezet ellenére még nagyon messze vagyunk attól, hogy teljesen szintetikus sejtet állítsunk elő.
Biológiai alapelvet írhat át egy friss kutatás: mégsem véletlenszerűek a DNS mutációi
A genetikusok egyik kedvenc modellélőlénye, a lúdfű vizsgálata meglepő dolgot tárt fel: kiderült, hogy a DNS-ében keletkező káros mutációkból kevesebb van a genom fontos részein. Bár az elfogadott álláspont szerint a mutációk véletlenszerűek, már eddig is voltak jelei, hogy ez az alapelv elavult.

Hamarabb teszi lábát az ember a Marsra, mint egy valós Jurassic Parkba
Elon Musk közeli munkatársa, Max Hodak elengedte a fantáziáját, amikor azt mondta, hogy 15 év alatt Jurassic Parkot lehetne teremteni. Senki ne élje bele magát.
Kapcsolódó cikkek