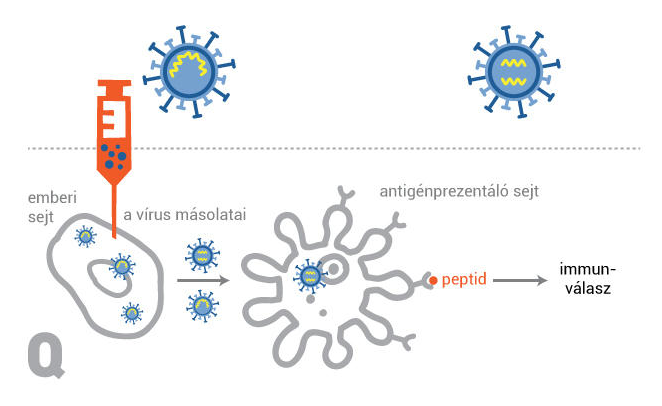
Hányat kell még aludni a vakcináig?
Miután a brit-svéd gyógyszergyártó, az AstraZeneca szeptember 8-án bejelentette, hogy leállította az Oxfordi Egyetemmel partnerségben fejlesztett, egyik legígéretesebb COVID-19-vakcina harmadik fázisban tartó, vagyis több ezer ember részvételével zajló tesztelését, sokan bepánikoltak, hogy csúszni fog az egyébként is még várhatóan hónapokig elhúzódó vakcinafejlesztés és így még inkább kitolódik a koronavírus-járvány várva várt befejeződése.
Néhány nappal később, szeptember 12-én aztán az AstraZeneca közölte, hogy újraindítja a kísérleteket – igaz, csak Nagy-Britanniában, az USA-ban és más országokban nem. Kétségbeesésre ugyanakkor semmi ok: egyrészt a klinikai kutatásokban bevett gyakorlat, hogy ha az egyik résztvevő súlyos tüneteket mutat, akkor leállítják az alanyok további gyógyszerezését, másrészt ez a visszalépés átmeneti, harmadrészt nagyon is megnyugtató hír, hogy a vakcinafejlesztésre nehezedő súlyos politikai nyomás ellenére a kutatók továbbra is az ágazatra jellemző biztonsági gyakorlatok szerint járnak el.
Sőt, miközben Oroszország már kihirdette magát a globális vakcinaverseny győztesének, Donald Trump pedig még az amerikai elnökválasztás, vagyis november 3. előtt szeretné megtenni ugyanezt, a gyógyszergyártó közösség közös lépéssel állt ki a tudományos kutatások legmagasabb etikai normái mellett. A COVID-vakcina tesztelésének harmadik fázisát bonyolító kilenc gyógyszercég vezetője a minap közös nyilatkozatot adott ki arról, hogy legfőbb prioritásuk a beoltott tesztalanyok biztonsága és jólléte, és csupán akkor fogják a szabályozó szervek, például az amerikai Élelmiszer- és Gyógyszerfelügyelet (FDA) jóváhagyását kérvényezni, ha vakcináik egy harmadik fázisú kutatásban is biztonságosnak és hatékonynak bizonyultak. Ezek fényében megnéztük, jelenleg pontosan hol tartunk az oltóanyag-fejlesztés folyamatában, és mikorra várható tömeges védőoltás.
2020-ban valószínűleg még nem lesz tömeges védőoltás
Margaret Harris, a WHO egyik szóvivője már az AstraZeneca bejelentése előtt úgy nyilatkozott, hogy a világszervezet 2021 második felénél korábban nem számít a koronavírus elleni széles körű védőoltásra. A Microsoft alapítója, Bill Gates, aki az utóbbi időben sokat foglalkozik egészségügyi fejlesztéssel a Bill & Melinda Gates Foundation keretében, a Wirednek adott augusztusi interjújában azt mondta, hogy a fejlett országok 2021 végére, míg a világ másik fele 2022 végére lehet képes véget vetni a világjárványnak.
Habár sokan csalódottak lehetnek, hogy a 2020-as évüket dobhatják a kukába, ha az oltóanyagok fejlesztésének szokásos időtartamát tekintjük, amely 10-15 évet is felölelhet, a SARS-CoV-2 vírus genomszekvenálását, vagyis 2020 januárját kezdőpontnak tekintve a szakértők által a vakcina megjelenéséig becsült 12-18 hónap valóságos rohamtempó.
Ráadásul a WHO legutóbbi, szeptember 8-i frissítése alapján jelenleg 145 vakcinajelölt a preklinikai, 34 pedig már a klinikai tesztelés fázisában tart. Más adatok alapján, például az amerikai Milken Institute gazdasági-egészségügyi think tank körképe szerint összesen 210 vakcinát fejlesztenek jelenleg világszerte, amelyek közül 30 lépett a klinikai tesztelés fázisába, a New York Times pedig 37 vakcináról tud, amelyeket már embereken is tesztelnek, és legalább 91 preklinikai állapotban lévő, állatokon tesztelt oltóanyagjelöltről adott hírt. Ezek alapján nehéz pontos körképet adni, ráadásul a számok folyamatosan változnak.

Preklinikai fázistól a több ezer fős vizsgálatokig
Amikor 2020. január elején a kínai hatóságok megosztották az új koronavírus genomszekvenciáját, megkezdődhetett a versenyfutás az idővel a diagnosztikai tesztek és a potenciális kezelési módszerek kifejlesztésére. Jelenleg ezekből több száz zajlik egyszerre szerte a világon, és bár a járvány alatt sosem látott mértékben felgyorsították az engedélyezési folyamatokat, szeptember elején még a legígéretesebb 9 vakcinajelölt is csak a 3. klinikai fázisban van.
Az alábbiakban ezeket fejlesztéseket szedtük össze, amelyek mindegyike a korábbi vakcinakisokosunkban az MTA kiadványára hivatkozva megírt, jól meghatározott menetrendet követi, mivel jelenleg ez a tudományosan széles körben elfogadott módszer arra, hogy egy hatékony vakcinát biztonságosan és a megfelelő engedéllyel forgalomba lehessen hozni.


Moderna
Ha a vakcinafejlesztés leggyorsabb versenyzőjét keressük, biztosan az amerikai Cambridge-ben székelő Moderna kerül az élre. Mindössze 25 nappal a koronavírus genomszekvenciájának megjelenése után, vagyis február elején a gyógyszercég közzétette, hogy a vállalat elvégezte az általa hírvivő RNS-ek felhasználásával fejlesztett vakcina első klinikai vizsgálatait. Az amerikaiak kedvenc koronaszakértője, Anthony Fauci által vezetett Nemzeti Allergia és Fertőző Betegségek Intézetével (NIAID) közösen kikísérletezett oltóanyag első fázisú, vagyis már embereken való tesztelését a cégnek elsőként március 4-én, gyorsított eljárással már engedélyezte is az FDA. A klinikai vizsgálatra jelentkező 45 felnőtt korú, 18 és 55 év közötti alanyt az oltóanyag dózisa szerint három csoportba osztották, majd 28 nap eltéréssel kétszer beoltották. Az első fázis pozitív eredményeit követően a Moderna májusban megkezdhette a vakcina második fázisú tesztelését.
Ezután júniusban fokozatosan 300 felnőtt korú (18 és 55 év közötti), valamint 300 időskorú (55 év feletti) tesztalanyt oltottak be az első fázishoz hasonlóan kétszer, 28 nap eltéréssel. A tesztalanyok egészségi állapotát egy évig nyomon követi a Moderna; időközben az FDA engedélyezte a cégnek, hogy július 27-én elkezdje a hírvivő RNS-alapú vakcina harmadik fázisú, körülbelül 30 ezer résztvevővel zajló tesztelését. A vizsgálatokat 30 amerikai államban és a fővárosban, Washingtonban végzik az orvosbiológiai kutatás-fejlesztést támogató kormányszerv, a BARDA, valamint az Operation Warp Speed nevű kormányzati program támogatásával, amely azt a kampányígéret jellegű célt tűzte ki, hogy az első vakcinák 2021 elején már elérhetőek legyenek.
AstraZeneca / Oxford
A brit-svéd AstraZeneca gyógyszercég és az Oxfordi Egyetem együttműködésével folyó vakcinafejlesztés viszonylag későn, április 30-án indult el, de akkorra már az Oxfordi Egyetem elkezdte saját oltóanyagjelöltjének összevont, első és második fázisú klinikai tesztelését. A ChAdOx1 nevű vakcina hatóanyagát egy csimpánzoknál náthát okozó adenovírus módosításával állították elő. A klinikai vizsgálat második fázisának eredményeit a Lancet folyóiratban tették közzé a kutatók, és az eredmények azt mutatták, hogy a vakcina biztonságos, nem okoz súlyos mellékhatásokat. Az oltás után 28 nappal az alanyok 91 százalékánál figyelték meg a semlegesítő antitestek termelését egy megengedőbb mérce szerint, míg a szigorúbb elemzés 37 százalékban állapította meg azok arányát, akiknél a vírus semlegesítésére alkalmas antitestek kialakultak. A két dózisban beoltott alanyok mindegyikénél a szigorúbb mérce szerint is működött a vakcina.
Az Egyesült Államok májusban az Operation Warp Speed programon keresztül 1,2 milliárd dollárral támogatta meg a projektet. Július végén az Egyesült Királyságban és Indiában, majd Brazíliában, Dél-Afrikában és szeptember elején az Egyesült Államokban is elindították a tesztelés harmadik fázisát, amihez több tízezer embert toboroztak. Jelenleg, néhány nappal később azonban ott tartunk, hogy az AstraZeneca mindenhol leállította a kísérleteket, miután az Egyesült Királyságban az egyik önkéntesnél „súlyos mellékhatás”, pontosabban gerincvelő-gyulladás (transverse myelitis) jelentkezett. Egyelőre vizsgálják, hogy a betegség a vakcina hatására alakult-e ki, és azt sem tudni, meddig szüneteltetik a tesztelést. Az MIT Technology Review úgy tudja, az AstraZeneca kutatói átfésülik az összes adatot, és a többi, harmadik fázisban zajló teszt lebonyolítói szintén végignézik, találkoztak-e hasonló mellékhatásokkal. Szeptember 12-én a cég bejelentette, hogy Nagy-Britanniában újraindítja a kísérleteket, de az USA-ban és a többi országban nem.
Pfizer / BioNTech / Fosun Pharma
Az amerikai-német-kínai együttműködésben a Modernához hasonlóan RNS-alapú vakcinákat fejlesztenek. Míg a Németországban végzett vizsgálat még az első klinikai fázisban járt, az amerikai tesztről készült jelentés már a második fázis tapasztalatait írta le: az alanyok két dózist kaptak két különböző erősségű oltóanyagból, és az oltásokat követően a covidos betegekhez képest 1,8–2,8-szoros mennyiségben mutattak ki a szervezetükben semlegesítő antitesteket, miközben a T-sejtek száma is nőtt. A kutatók azt is kimutatták, hogy a BNT162b2 oltóanyag-változat sokkal kevesebb mellékhatást, például lázat és fáradtságot okozott, így a kombinált második és harmadik fázisú tesztelést már ezzel folytatják.
Ezt a vizsgálatot július 27-én kezdték meg 30 ezer önkéntessel az Egyesült Államokban, valamint Argentínában, Brazíliában és Németországban. Még ugyanebben a hónapban a Trump-adminisztráció 1,9 milliárd dolláros szerződést kötött ezekkel a cégekkel, hogy decemberre 100 millió adagnyi vakcinát szállítsanak le, további 500 millió adagra pedig opciós szerződést írtak alá. Japán júliusban ugyancsak leszerződött 120 millió adagra. Albert Bourla, a Pfizer ügyvezető igazgatója szeptember elején úgy nyilatkozott, hogy 2020 októberének közepére már készen lehet a vakcina, de még sok az „ismeretlen faktor”. Amennyiben engedélyeznék a vakcinájukat, a Pfizer becslései szerint több mint 1,3 milliárd adagot gyárthatnak le 2021 végéig.
A kínaiak: CanSino / Sinovac / Sinopharm
A tiencsini Cansino Biologics az ország Biológiai Intézetével közösen az AstraZenecához hasonlóan egy nem replikálódó vírusvektoron alapuló vakcinát tesztel, vagyis a koronavírus tüskéjét kódoló géneket egy ártalmatlan, korlátozott fertőzőképességű adenovírussal juttatják a szervezetbe, hogy a sejtek maguk készíthessék elő az immunválaszt. A tesztelés első fázisának eredményeit júniusban a Lancet folyóiratban tették közzé, majd júliusban kijöttek a második fázis eredményeivel is. A vizsgálatban 508-an vettek részt Vuhanban, viszont a két dózisban beadott oltóanyagból az egyik csoport 59 százaléka, míg a másiknak csak 47 százaléka termelt semlegesítő antitesteket. Ennek ellenére Szaúd-Arábia egészségügyi minisztériuma augusztus 9-én bejelentette, hogy a CanSino az arab országban 5 ezer önkéntessel folytatja le a vakcina harmadik fázisú tesztelését, és augusztus 30-án 40 ezer résztvevővel Pakisztánban is megkezdtek egy hasonló vizsgálatot.
A pekingi Sinovac Biotech a CoronaVac nevű vakcinajelöltet teszteli. A cég júniusban jelentette be, hogy a kombinált első és második fázisú, 743 önkéntes részvételével elvégzett vizsgálatában senki nem számolt be súlyos mellékhatásokról, és a vakcina hatékony immunválaszt eredményezett. Ezután a Sinovac júliusban Brazíliában, augusztusban pedig Indonéziában kezdte meg a harmadik fázisú tesztelést. Még ugyanebben a hónapban a Sinovac 2021 márciusáig 40 millió adagnyi vakcina leszállítására szerződött az indonéz kormánnyal.
A harmadik kínai fejlesztés a Sinopharm állami cégen keresztül zajlik, amely a Vuhani Biológiai Készítmények Intézete által fejlesztett, inaktivált vírust használó vakcinát kezdte el tesztelni. Az első fázisban, április 12-én 96 résztvevőn a kínai Henan tartományban vizsgálták az oltóanyag hatásait, ezt súlyos mellékhatások hiányában rögtön követte is egy második fázisú tesztelés 224 önkéntessel. A JAMA folyóiratban júliusban megjelent tanulmány eredményei azt mutatták, hogy a vakcina hatékony, ugyanakkor az alanyok közül néhányan lázról és más, enyhébb mellékhatásokról számoltak be. Ezzel együtt a Sinopharm július közepén megkezdte a 15 ezer önkéntessel induló harmadik klinikai fázist Abu-Dzabiban, ahol az emirátus egészségügyi minisztere kapta meg a legelső dózist az oltóanyagból, majd Peruban és Marokkóban a következő hónapban indították útjára a tesztelést. Annak ellenére, hogy még javában zajlik a tesztelés, a kínai kormány júliusban már engedélyezte a Sinopharm egyik vakcinájának sürgősségi használatát, és a cég szóvivője augusztus 18-án, a kínai kormány szócsövének számító Global Timesnak úgy nyilatkozott, hogy 2020 végére már széles körben elérhetővé tehetik az oltóanyagot.
Az oroszoké már a spájzban?
Augusztus 11-én Vlagyimir Putyin orosz elnök teljesen váratlanul bejelentette, hogy az orosz hatóságok engedélyezték a világ első műholdja, a Szputnyik–1 után Szputnyik V névre keresztelt vakcinát, még mielőtt a harmadik fázisú tesztelés megkezdődhetett volna. Az orosz egészségügyi minisztériumhoz tartozó Nyikolaj Gamaleja Nemzeti Járványügyi és Mikrobiológiai Kutatóintézet júniusban kezdte meg az akkor még Gam-Covid-Vac nevet viselő, két adenovírus kombinációjával előállított oltóanyag tesztelését.
Putyin bejelentését a szakértők rendkívül kockázatosnak minősítették, és Oroszország később gyakorlatilag vissza is vonta a bejelentést, mondván, hogy a jóváhagyás csak amolyan „feltételes forgalomba hozatali engedély”, és a Szputnyik V sorsa a harmadik fázisú tesztek eredményeitől függ. Sőt, az eredetileg mintegy kétezer önkéntessel tervezett vizsgálatokat 40 ezres létszámúra bővítették. A tesztelést augusztus 31-én kezdték és a tervek szerint 2021 májusára fejezik be. Mindenesetre az orosz kutatóintézet tudósai csupán három héttel Putyin nagy bejelentését követően, szeptember elején publikálták COVID-vakcinájuk kombinált első és második fázisú tesztelésének eredményeit.
A kínaiakon, oroszokon, amerikaiakon és briteken kívül még Ausztrália szállt be eredményesen a globális vakcinaversenybe. Jelenleg a victoriai székhelyű Murdoch Gyermekegészségügyi Kutatóintézet (MCRI) kísérletezik harmadik fázisú tesztelési szakaszban lévő vakcinajelöltjével, a BRACE-szel, amely tulajdonképpen az 1900-as évek elején kifejlesztett, tüdővész ellen védő BCG-oltás továbbfejlesztett változata.
Fellélegezhetünk, ha megvan az oltóanyag?
Egyelőre Oroszországon és Kínán kívül, ahol augusztusban már szabadalmat kapott az első, Ad5-nCOV nevű vakcinajelölt, más ország nem számolt be arról, hogy a sikeres védőoltás-fejlesztés utolsó lépcsőihez érkezett volna. Valójában a lefektetett etikai és biztonsági szabályok szerint a vakcinák elfogadásáról csak azután dönthetnének az egyes országok egészségügyi hatóságai, hogy a klinikai vizsgálatokat végző cégek sikeres harmadik fázisú tesztelésről számoltak be. Az FDA engedélyezési kritériumai szerint ez például azt jelenti, hogy több ezer ember beoltását követően az oltóanyag összességében véve legalább 50 százalékkal csökkenti a tünetekkel járó COVID-19 betegség előfordulását, és legalább 30 százalékos hatékonysággal bír. Rendes körülmények között ehhez hozzájön az is, hogy az oltóanyag biztonságosságát legalább 3000 alanyon legalább egy éven keresztül megvizsgálták - enélkül az FDA teljes engedélyt nem tud adni, csak vészhelyzeti különengedélyt. Ha ez a COVID-19-vakcinák esetén is így lenne, a jelenleg futó harmadik fázisú vizsgálatokat elnézve jövő nyár előtt nem lehetne oltóanyagot engedélyeztetni.
Stephen Hahn, az FDA vezetője augusztus 7-én mindenesetre úgy nyilatkozott, hogy a jóváhagyást megelőzően a hatóság a hagyományos hatékonysági és biztonsági szabványok szem előtt tartásával vizsgálja meg a vakcinajelölteket, hozzátette azonban, hogy megfontolják a vészhelyzeti különengedély nyújtotta lehetőségeket. Korábban az AstraZeneca kutatói is úgy nyilatkoztak, hogy októberben már rendelkezésre állhatnak olyan kísérleti vakcinák, amiket vészhelyzet esetén be lehet vetni, sőt az AstraZeneca szerint az engedélyezés után a cég akár kétmilliárd dózist is le tud gyártani. Margaret Harris, az ENSZ korábban idézett szóvivője a klinikai tesztelésről szólva viszont óva intett az elhamarkodottságtól: azt mondta, a vizsgálatok harmadik fázisának „tovább kell tartania, mert meg kell bizonyosodnunk arról, a vakcina ténylegesen véd a vírustól, és biztonságos.” Erre pedig már csak amiatt is szükség van, mert egy elsietett, nem hatékony, sőt egészségügyi problémákat okozó oltás az egész tudományba vetett bizalmat alapjaiban rendítené meg, nem beszélve arról, micsoda remek érveket teremtene az oltásellenes mozgalom képviselőinek.
Védőoltások tömeges hozzáférése
Mindenesetre még ha gyorsított eljárásban engedélyeznék is az egyes országokban a COVID-19 vakcinákat, rengeteg technológiai, erőforrásbeli, elosztási és logisztikai kérdés marad. Fiolák és fecskendők millióira, az oltóanyagokat megfelelő, vagyis 2-8 fok közötti hőmérsékleten tartó hűtők tízezreire lehet szükség, nem beszélve a szállítmányozási problémákról és arról, hogy némelyik RNS-alapú védőoltásjelölt olyan technológiára épül, amilyet eddig még sosem vetettek be engedélyezett oltásnál.
A szállítmányozási szakemberek július végén például egyetértettek abban, hogy a globális ellátási lánc jelenleg nincs abban a helyzetben, hogy meg tudná oldani a koronavírus elleni oltóanyag megfelelő szállítmányozását, és globális stratégia nélkül ez nem is fog változni. Julian Sutch, az Emirates SkyCargo gyógyszerészeti részlegének vezetője nemrég úgy becsülte, hogy egy Boeing 777 teherszállító egymillió adagnyi vakcinát képes leszállítani, ami azt jelenti, hogy a világ népessége felének két dózisban történő beoltásához közel 8 ezer teherszállító repülőgépre lenne szükség.
Az Egyesült Államokban az Operation Warp Speed keretében 8 milliárd dollárt tettek félre a vakcinafejlesztésre és -gyártásra, és már közel 500 millió dollárt költöttek a COVID-19-oltásokhoz szükséges fiolák és fecskendők előállításának felgyorsítására. Emellett a brit multi, a Deloitte 15 millió dolláros szerződést kötött Washingtonnal arra, hogy kövesse a vakcina elosztását és adminisztrációját. Mindenesetre a Trump-adminisztráció nagyon is optimista ígéretei ellenére, amelyek szerint 2021 elejére már egy addigra elkészített, részletes elosztási terv alapján 300 millió adagnyi, hatékony és biztonságos védőoltást tesznek elérhetővé, a legtöbb szakértő - például az MTA is - úgy becsüli, hogy a vakcinák tömeges gyártása és hozzáférése a jövő év közepénél korábban nem várható. Abban az esetben, persze, ha minden a várakozásoknak megfelelően alakul.
Kapcsolódó cikkek a Qubiten:

Már az év vége előtt megjelenhetnek az első engedélyezett koronavírus-vakcinák
Moderna, AstraZeneca, Pfizer: az elmúlt hetekben sorra jelentek meg a COVID-19 elleni vakcinák nagyobb embercsoportokon végzett klinikai vizsgálatainak eredményei, és úgy tűnik, a legígéretesebb oltások ki tudják váltani a kívánt immunválaszt a koronavírussal szemben. Kérdés, hogy sikerül-e eleget gyártani a vakcinából, és hogy mi lesz a makacs szkeptikus oltásellenesekkel.

Trump még a választás előtt vakcinát akar, az FDA lerövidítheti az engedélyezési procedúrát
Miután Oroszországban és Kínában is felgyorsult a koronavírus-vakcinák engedélyezése, Donald Trump az amerikai szabályozókat is sürgeti, hogy még a novemberi elnökválasztás előtt be tudja oltani a népet. Anthony Fauci járványguru szerint ez kockázatos, miközben felesleges felhajtás nélkül is lehet még idén vakcina.
Az MTA honlapja szerint a jövő év közepére várható a megbízható SARS-CoV-2 vakcinák tömeges gyártása
A hat vizsgálatból hármat amerikai, kettőt pedig kínai gyógyszercégeknél végeznek, még egy fejlesztést az Oxfordi Egyetem Edward Jenner Intézete jegyez. A magyar kormány az utóbbiból ötmillió adagra már leszerződött.
Kapcsolódó cikkek

Az MTA honlapja szerint a jövő év közepére várható a megbízható SARS-CoV-2 vakcinák tömeges gyártása